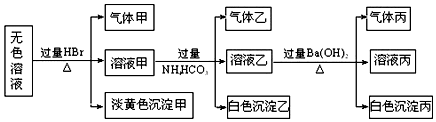
题目内容
1.下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是( )| A. | 向水中加入少量的CH3COONa | B. | 向水中加入少量的NaHSO4 | ||
| C. | 加热水至100℃,pH=6 | D. | 向水中加少量的明矾 |
分析 酸、碱或强酸强碱形成的酸式盐能电离出大量的氢离子或氢氧根,能抑制水的电离,使水的电离平衡左移;盐类的水解能促进水的电离,使水的电离平衡右移;溶液显酸性的根本原因是氢离子浓度大于氢氧根浓度,而显酸性的溶液通常有:酸溶液,强酸弱碱盐溶液等.据此分析.
解答 解:A、醋酸钠溶于水后能水解,故能促进的电离,水的电离平衡右移,但其是强碱弱酸盐,故水解显碱性,故A错误;
B、NaHSO4是强酸强碱的酸式盐,溶于水能完全电离出大量的氢离子,故溶液显酸性,但对水的电离有抑制作用,即水的电离平衡左移,故B错误;
C、将水加热,水的电离平衡右移,但纯水永远显中性,故C错误;
D、明矾是强酸弱碱盐,水解显酸性,且水解对水的电离有促进作用,故D正确.
故选D.
点评 本题考查了酸碱盐和加热等外界条件对水的电离的影响和溶液的酸碱性,难度不大,应注意纯水永远显中性,但显中性时pH不一定为7.

练习册系列答案
相关题目
1.(1)表是第三周期部分元素氧化物和氟化物的熔点和摩氏硬度:
①两种氧化物MgO和SiO2的晶体类型分别是离子晶体、原子晶体
②表格中几种氟化物熔点差异的主要原因是NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高
③1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为2:1
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是SiF4.
(2)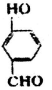 比
比 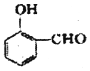 的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3,2 | 6.0 | 6.5 | 7 |
②表格中几种氟化物熔点差异的主要原因是NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高
③1mol SiO2中含有4molSi-O键,Si和O原子配位数之比为2:1
④NaF、MgF2、MgO、SiF4、SiO2中化学键能够代表分子真实组成的是SiF4.
(2)
 比
比  的沸点高(填“高”或“低”).
的沸点高(填“高”或“低”).
2.下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| B | 将SO2气体通入紫色石蕊溶液中,观察溶液颜色的变化 | 能证明SO2具有漂白性 |
| C | 向2mL1mol•L-1NaOH溶液中先加入0.2mL1mol•L-1FeCl3溶液,再加入0.2mL1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴“84”消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,“84”消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
9.工业上根据污水中所含物质或离子的不同,有多种处理方法:
请回答下列问题:
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
如图为化学沉淀法处理污水的工艺流程示意图.
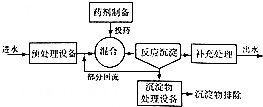
①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |

①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
13.某二价阳离子含24个电子,它的质量数为59,则该离子核内中子数是( )
| A. | 22 | B. | 26 | C. | 33 | D. | 35 |
10.表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题.
(1)元素⑦在元素周期表位置是第三周期ⅣA族.
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是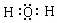 .
.
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
| ① | ||||||
| ② | ③ | ④ | ||||
| ⑤ | ⑥ | ⑦ | ⑧ |
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式).HNO3>H2CO3>H2SiO3或(H4SiO4)
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)O2->Na+>Al3+.
(4)由①和④组成的元素质重比为1:8的化合物的电子式是
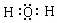 .
.(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为.2H2O+2Al+2OH-=2AlO2-+3H2↑.
11.下列分散系能产生“丁达尔效应”的是( )
| A. | 稀硫酸 | B. | 硫酸铜溶液 | C. | 氢氧化铁胶体 | D. | 酒精溶液 |