题目内容
14.将一质量分数为ω的KOH溶液蒸发掉m g水后,质量分数恰好变为2ω,体积为V(溶液中无晶体析出),则浓缩后溶液的物质的量浓度为( )| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
分析 依据溶液浓缩前后所含溶质的质量不变,结合物质的量浓度公式计算解答.
解答 解:A设蒸发前溶液的质量为x,则
xω=(x-m g)×2ω,x=2m g,浓缩后溶液的物质的量浓度:c=$\frac{2mω}{56V}$ mol•L-1=$\frac{mω}{28V}$mol•L-1.
故选:A.
点评 本题考查了物质的量浓度的有关计算,明确溶液浓缩前后溶质的物质的量、物质的质量不变是解题关键,题目难度不大.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
15. 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
请按要求回答下列问题:
(1)X的单质的电子式: ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.
(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
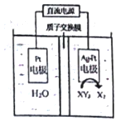
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
 四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.
四种短周期元素在周期表中的相对位置如下表所示,其中Z原子最外层电子数是其电子层数的2 倍.元素M与Z同周期,且原子半径是同周期中最大的.元素R是第四周期的过渡元素;R有甲、乙两种常见氢氧化物,其中甲在常温下置于空气中,会由白色变为灰绿色,最后变为红褐色的乙.| X | Y | |
| Z | W |
(1)X的单质的电子式:
 ;W最高价氧化物的水化物的化学式:HClO4.
;W最高价氧化物的水化物的化学式:HClO4.(2)M、Z、W分别形成的简单离子的半径由大到小顺序为S2->Cl->Na+(填离子符号);写一个能说明元素W比元素Z的非金属性强的化学方程式:H2S+Cl2=S2↓+2HCl.
(3)甲变为乙的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)常温下,当用200mL 1mol•L-1的MOH溶液吸收4.48L(已折算为标准状况)ZY2时,所得溶液的主要溶质(填化学式)为NaHSO3;此时溶液pH<7,则其中含Z元素的几种粒子(忽略ZY2)的浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).
(5)工业上用电化学法治理酸性废液中的XY3-的原理如图示,其阴极的反应式为2NO3-+12H++10e-=N2↑+6H2O.
2.为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇.一定条件下发生反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.
(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
在450℃、0~1min,υ(CH3CH2OH)=0.0167mol/(L•min);此温度下该反应的化学平衡常数为6.22(结果保留三位有效数字).
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).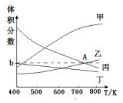
(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).

(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
9.工业上根据污水中所含物质或离子的不同,有多种处理方法:
请回答下列问题:
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
如图为化学沉淀法处理污水的工艺流程示意图.
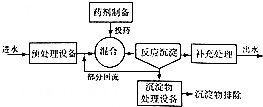
①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
| 污水中所含离子 | H+、OH- | CN- | Cu2+、Hg2+ |
| 处理方法 | 中和法 | 氧化还原法 | 沉淀法 |
(1)在中和法中,若用CO2来除去污水中的某种离子,其离子方程式为OH-+CO2=HCO3-;
(2)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,使其转化为CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为5Cl2+2CN-+4H2O═10Cl-+2CO2+N2+8H+;
(3)已知有关物质的Ksp如下表:
| 物质 | Cu(OH)2 | CuS | FeS | PbS | HgS | CdS |
| Ksp | 2.2×10-20 | 8.5×10 -45 | 6.3×10 -18 | 3.4×10-28 | 4×10-53 | 8×10-29 |

①在沉淀法中,NaOH与Na2S相比,除去污水中的Cu2+效果较好的是Na2S;
②若某污水中能与上述沉淀剂反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入该沉淀剂1.6g(精确到0.1).
19.设NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 标准状况下,VL水含有的氧原子个数约为V/22.4 NA | |
| B. | 常温常压下,1 mol 碳烯( CH2)所含的电子总数为8NA | |
| C. | 标准状况下,含NA个氩原子的氩气体积约为22.4L | |
| D. | 1mol OH-参与电解,提供的电子数目为NA个 |
4.四丁基氢氧化铵[(C4H9)4NOH]常作电子工业清洗剂.以四丁基溴化铵[(C4H9)4NBr]为原料,采用电渗析法合成(C4H9)4NOH,原理如图(c、d、e为离子交换膜).下列说法不正确的是( )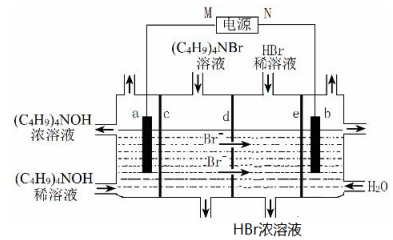

| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.