题目内容
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
分析 温度相同时水的离子积常数相同,酸或碱抑制水电离,根据氢离子浓度或氢氧根离子浓度结合水的离子积常数计算水电离出的氢离子浓度.
解答 解:醋酸是弱电解质,醋酸溶液中氢离子浓度小于醋酸浓度,物质的量浓度均为0.1mol/L的酸溶液中,氢离子浓度:③<①=0.1mol/L<②=0.2mol/L,氢氧化钠溶液中氢氧根离子浓度=0.1mol/L,酸或碱都抑制水电离,同浓度一元强碱与一元强酸对水的抑制程度相同,
离子浓度越大,抑制水电离程度越大,所以由水电离出的c(H+)的大小关系是④>③>①=⑤>②,故A错误,B正确;此五种溶液中只有氯化铵促进水的电离,故C错误,D正确,故选BD.
点评 本题考查了水电离的影响因素,明确酸和碱抑制水电离、含有弱根离子的盐促进水电离是解本题关键,知道氢离子或氢氧根离子浓度和抑制水电离的关系,难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
9.下列反应的离子方程式中,错误的是( )
| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
10.醇中的氧被硫替换称为硫醇.硫醇一般有较强的臭味.如:人的口臭是由于分泌出带臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH),警察驱散抗议者的臭鼬弹主要成分是丁硫醇(C4H9SH).下列说法你认为正确的是( )
| A. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 | |
| B. | 乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 | |
| C. | 甲硫醇、乙硫醇与丁硫醇互为同系物 | |
| D. | 沸点不同的丁硫醇有两种 |
7.将1.12g铁粉加入2mol/L氯化铁溶液25mL中,充分反应后结果是( )
| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
14.根据所学化学知识,判断施用钾肥草木灰(主要成份是K2CO3)时,不能和下列化肥混合使用的是( )
| A. | NH4HCO3 | B. | KCl | C. | CO(NH2)2 | D. | KNO3 |
4. (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(2)请在下表中用相应的化学方程式表示出该化合物(A)可能具有的性质.
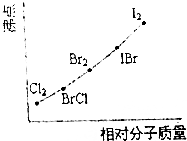
(3)图是部分卤素单质和XX′型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高.其原因是分子晶体的熔沸点随分子量的增大而升高.试推测化合物(A)的沸点所处的最小范围Br2<ICl<IBr(用有关物质代表沸点数据).
 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
11.利用相似相溶这一经验规律可说明的事实是( )
①HCl易溶于水②I2微溶于水③C12能溶于水④NH3易溶于水.
①HCl易溶于水②I2微溶于水③C12能溶于水④NH3易溶于水.
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
15.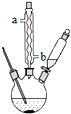 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
按下列合成步骤回答问题:
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式 .
.
③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.