题目内容
16.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源之一,而加以控制.铝在下列使用场合须加以控制的是①制铝锭②制易拉罐③制电线电缆④制牙膏皮⑤用明矾净水⑥制炊具⑦用明矾和苏打作食物膨化剂⑧用Al(OH)3制成药片治胃病⑨制防锈油漆( )
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑨ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
分析 铝在人体内积累可使人慢性中毒,铝进入人体的主要途径是通过消化系统.
解答 解:①制铝锭,人的消化系统不直接接触,对人体无影响,故不选;
②制易拉罐,饮料上粘的铝能通过消化系统或呼吸系统进入人体,所以正确.
③铝作电线电缆与人的消化系统不直接接触,铝不会因使用电缆进入人体,所以错误.
④牙膏皮上的铝能随通过消化系统进入人体,所以正确.
⑤明矾净水后,饮用水中的铝元素能通过消化系统或呼吸系统进入人体,所以正确.
⑥铝作制炊具,铝会随食物通过消化系统或呼吸系统进入人体,所以正确.
⑦用明矾和苏打混合作食品膨化剂,食品中的铝元素能通过消化系统或呼吸系统进入人体,所以正确.
⑧服氢氧化铝胶囊,较多的铝会被摄入,所以正确.
⑨制防锈漆,正常情况下铝与人的消化系统不直接接触,铝不会因使用电缆进入人体,所以错误.
故选C.
点评 关爱生命,拥抱健康”是人类追求的永恒主题,对营养元素与人体健康的考查也就成了热点之一,特别是元素的分类、元素的生理功能和对人体的影响等内容.

练习册系列答案
相关题目
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
7.硫酸亚铁铵晶体[化学式为x(NH4)2SO4•yFeSO4•zH2O]呈浅绿色,易溶于水,不溶于酒精,是一种重要的化学试剂.某化学兴趣小组设计以下实验制备并定量测定其组成.
已知:
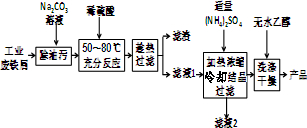
Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
已知:
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |

Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
1.X、Y、Z为三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应X+2Y?2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
| A. | $\frac{ab}{5}$×100% | B. | $\frac{2ab}{5}$×100% | C. | $\frac{2ab}{5b}$×100% | D. | $\frac{ab}{5a}$×100% |
8.在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
5.五种短周期元素在周期表中的位置如图所示,其中R元素原子的最外层电子数等于其电子层数的2倍,下列判断正确的是( )
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
6.下列水解方程式的书写中,正确的是( )
| A. | CH3COO-的水解方程式:CH3COO-+H2O?CH3COOH+OH- | |
| B. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | Fe3+的水解方程式:Fe3++3OH-?Fe(OH)3 |
 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.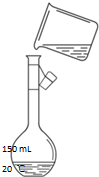 实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题:
实验室用氯化钠固体配制1.00mol/L的NaCl溶液100mL,回答下列问题: