题目内容
7.将1.12g铁粉加入2mol/L氯化铁溶液25mL中,充分反应后结果是( )| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
分析 1.12g铁物质的量n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,25mL 2mol/L氯化铁溶液中n(Fe3+)=0.025L×2mol/L=0.05mol,发生的离子反应为Fe+2Fe3+═3Fe2+,结合反应及离子的检验来解答.
解答 解:1.12g铁物质的量n(Fe)=$\frac{1.12g}{56g/mol}$=0.02mol,25mL 2mol/L氯化铁溶液中n(Fe3+)=0.025L×2mol/L=0.05mol;
发生的反应为:Fe+2Fe3+═3Fe2+;
0.02mol 0.04mol 0.06mol
由上述反应可知:三价铁离子剩余0.01mol,溶液中含有Fe3+物质的量为0.01mol,Fe2+物质的量为0.06mol,无金属铁剩余;
A、铁无剩余,故A错误;
B、溶液中有剩余的三价铁离子,往溶液中滴入无色KSCN溶液,显红色,故B正确;
C、Fe2+和Fe3+的物质的量之比为6:1,故C正确;
D、氧化产物与还原产物的物质的量之比为1:2,故D错误;
故选BC.
点评 本题考查氧化还原反应计算及铁的性质,为高频考点,把握发生的反应及物质的量关系等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
2.下列特点中,所谓“合金”必须具有的是( )
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
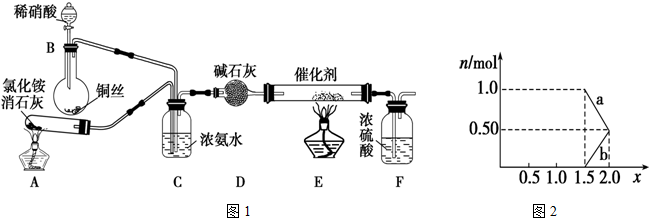

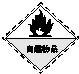

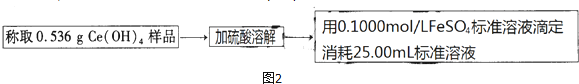
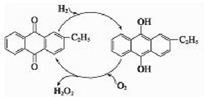 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.