题目内容
10.醇中的氧被硫替换称为硫醇.硫醇一般有较强的臭味.如:人的口臭是由于分泌出带臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH),警察驱散抗议者的臭鼬弹主要成分是丁硫醇(C4H9SH).下列说法你认为正确的是( )| A. | 在水溶液中,乙硫醇比乙醇更难电离出H+离子 | |
| B. | 乙硫醇在空气中燃烧生成二氧化碳、三氧化硫和水 | |
| C. | 甲硫醇、乙硫醇与丁硫醇互为同系物 | |
| D. | 沸点不同的丁硫醇有两种 |
分析 A.乙硫醇中硫的电负性小于乙醇中的氧;
B.根据硫元素燃烧生成二氧化硫;
C.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;
D.根据丁基的种类等于丁硫醇异构体.
解答 解:A.乙硫醇中硫的电负性小于乙醇中的氧,乙硫醇比乙醇更容易电离出H+离子,故A错误;
B.丁硫醇含有碳硫氢元素,丁硫醇在空气中燃烧生成二氧化碳、二氧化硫和水,故B错误;
C.甲硫醇、乙硫醇与丁硫醇,结构相似,在分子组成上相差一个或若干个CH2原子团,互为同系物,故C正确;
D.丁基有四种,沸点不同的丁硫醇有四种:CH3CH2CH2CH2SH,CH3CH(SH)CH2CH3,CH2(SH)CH(CH3)CH3,(CH3)3C-SH,故D错误;
故选C.
点评 本题考查基本概念及物质的结构和性质,为高频考点,明确基本概念内涵及物质中官能团及其性质关系是解本题关键,易错选项是B,S元素应该生成二氧化硫而不是三氧化硫,题目难度不大.

练习册系列答案
相关题目
20.利用如图进行实验,下列实验结果不能说明结论的是( )
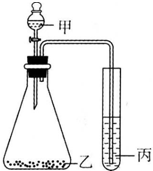

| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性.“钴酞菁”的分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
2.下列特点中,所谓“合金”必须具有的是( )
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
(1)具有金属特性
(2)通过熔合加工
(3)有两种或两种以上金属(或金属与非金属)
(4)铸造性很好.
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
7.硫酸亚铁铵晶体[化学式为x(NH4)2SO4•yFeSO4•zH2O]呈浅绿色,易溶于水,不溶于酒精,是一种重要的化学试剂.某化学兴趣小组设计以下实验制备并定量测定其组成.
已知:
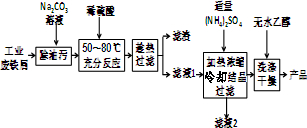
Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
已知:
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |

Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
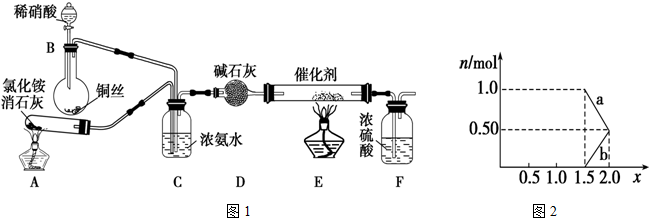
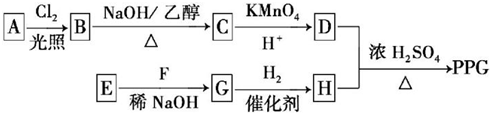
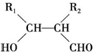 .
. .
. ,反应类型为消去反应.
,反应类型为消去反应. .
. (写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).
(写结构简式);D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是c(填标号).