题目内容
15.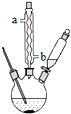 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
(1)制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸.
①球形冷凝管的作用是冷凝回流,其进水口是b(填“a”或“b”).
②三颈瓶中反应的离子方程式
 .
.③分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
(2)制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入61.0g苯甲酸和适量的32%的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
⑤控制温度为70℃的方法是水浴加热.
⑥加入活性炭的作用是吸附色素.
⑦若提纯得到46.8g苯甲酸钠.则苯甲酸钠的产率是65.0%.
分析 (1)①甲苯易挥发,冷凝回流;采取逆流原理通入冷凝水;
②甲苯为酸性高锰酸钾溶液氧化生成苯甲酸,高锰酸根还原得到锰离子;
③苯甲酸微溶于水,常温下为晶体,采取过滤方法分离;
④反应得到溶液中含有硫酸锰、硫酸钾,硫酸锰、硫酸钾易溶于水,苯甲酸微溶于水,可以利用重结晶进行提纯;
(2)⑤控制温度为70℃,可以采取水浴加热;
⑥在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,说明活性炭吸附色素;
⑦根据苯甲酸计算苯甲酸钠的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)①甲苯易挥发,冷凝管冷凝回流挥发的甲苯,减少损失;采取逆流原理通入冷凝水,充分冷凝,即从b口通入冷凝水,
故答案为:冷凝回流;b;
②甲苯为酸性高锰酸钾溶液氧化生成苯甲酸,高锰酸根还原得到锰离子,反应离子方程式为: ,
,
故答案为: ;
;
③苯甲酸微溶于水,常温下为晶体,采取过滤方法分离,需要的仪器有:烧杯、玻璃棒、漏斗,
故选:BCD;
④反应得到溶液中含有硫酸锰、硫酸钾,分离出的苯甲酸晶体中可能含有的杂质是K2SO4、MnSO4,硫酸锰、硫酸钾易溶于水,苯甲酸微溶于水,可以利用重结晶进行提纯,
故答案为:K2SO4、MnSO4;重结晶;
(2)⑤控制温度为70℃,低于水的沸点,可以采取水浴加热,受热均匀,便于控制温度,
故答案为:水浴加热;
⑥在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,说明活性炭吸附色素,
故答案为:吸附色素;
⑦61.0g苯甲酸完全转化可以生成苯甲酸钠质量为61g×$\frac{144}{122}$=72g,苯甲酸钠的产率=$\frac{46.8g}{72g}$×100%=65.0%,
故答案为:65.0%.
点评 本题考查物质制备实验,涉及物质的分离提纯、仪器的使用、产率计算等,清楚原理是解答的关键,注意对题目信息的应用,是对学生综合能力的考查,题目难度中等.

 阅读快车系列答案
阅读快车系列答案①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
已知:
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
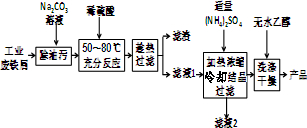
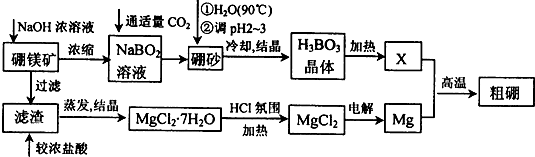
Ⅰ.硫酸亚铁铵晶体的制备(如图所示)
(1)Na2CO3溶液能用于除油污的原因是(用离子方程式表示)CO32-+H2O?HCO3-+OH-.
(2)加入适量(NH4)2SO4后,经加热浓缩、冷却结晶、过滤就能得到硫酸亚铁铵晶体的原因是相同温度下,硫酸亚铁铵晶体在水中的溶解度小于(NH4)2SO4、FeSO4•7H2O.
(3)用无水乙醇除去硫酸亚铁铵晶体表面的水分,而不能在空气中直接烘干的原因是防止在加热过程中晶体失去结晶水及被氧化.
Ⅱ.定量测定硫酸亚铁铵晶体的组成
步骤1:结晶水的测定
(4)准确称量47.040g纯净的硫酸亚铁铵晶体并隔绝空气加热至恰好失去结晶水,称得剩余固体34.080g,则n(结晶水)=0.72mol.再将全部剩余固体溶于水配成250mL溶液.
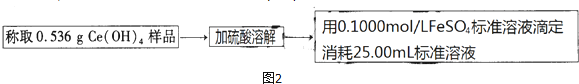
步骤2:Fe2+的测定
(5)取25.00mL步骤1中所配溶液于锥形瓶中,将0.1000mol/L 酸性高锰酸钾标准溶液装入
酸式滴定管中进行滴定,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,滴定至终点的现象是滴入最后一滴标准液时,锥形瓶内溶液变为紫红色,且半分钟不恢复原色,共计消耗酸性高锰酸钾标准溶液24.00mL.
步骤3:SO42-的测定 向25.00mL步骤1中所配溶液中加入足量BaCl2溶液后,经过滤、洗涤、干燥后,称量沉淀质量为5.592g.
步骤4:计算
(6)x:y:z=1:1:6.
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.