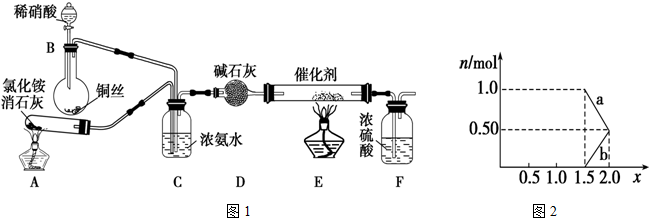
题目内容
9.下列反应的离子方程式中,错误的是( )| A. | 铁跟稀硫酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 醋酸跟氢氧化钾溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| D. | 碳酸镁跟硫酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
分析 A.反应生成硫酸亚铁和氢气;
B.碳酸氢钙完全电离,反应生成氯化钙、水、二氧化碳;
C.反应生成醋酸钾、水;
D.反应生成硫酸镁、水、二氧化碳.
解答 解:A.铁跟稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A正确;
B.碳酸氢钙溶液跟盐酸反应的离子反应为HCO3-+H+═H2O+CO2↑,故B错误;
C.醋酸跟氢氧化钾溶液反应的离子反应为CH3COOH+OH-═CH3COO-+H2O,故C正确;
D.碳酸镁跟硫酸反应的离子反应为MgCO3+2H+═Mg2++H2O+CO2↑,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
20.利用如图进行实验,下列实验结果不能说明结论的是( )
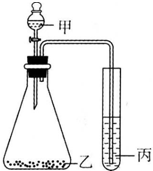

| A. | 甲-盐酸,乙-石灰石,丙-硅酸钠溶液,证明酸性:盐酸>H2CO3>H2SiO3 | |
| B. | 甲-盐酸,乙-亚硫酸钠,丙-溴水,证明还原性:HCI>SO2>HBr | |
| C. | 甲-浓盐酸,乙-高锰酸钾,丙-溴化钾,证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲-氯化铵饱和溶液,乙-烧碱,丙-氯化铝,证明碱性:NaOH>NH3•H2O>Al(OH)3 |
4.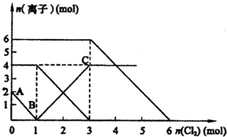 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
 已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-、2Fe3++2I-═2Fe2++I2,向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.则下列有关说法中,不正确的是( )| A. | 还原性:Fe2+>I->Br- | |
| B. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:2:3 | |
| C. | 原混合溶液中FeBr2的物质的量为6 mol | |
| D. | 当通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- |
1.我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性.“钴酞菁”的分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似.下列说法中不正确的是( )
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
 水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:
水合肼(N2H4•H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为: