题目内容
4.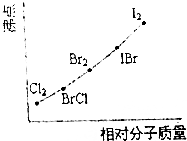 (1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl.
(1)在已知存在H2、Cl2、I2、HCl和Hl的时代,根据原子通过共价键形成分子的基本特点(如下图),推测还可能存在的一种化合物(A),其化学式为ICl. | H- | Cl- | I- | |
| -H | H-H | H-Cl | H-I |
| -Cl | H-Cl | Cl-Cl | |
| -I | H-I | I-I |
| 反应物 | 化合物(A) | Br2 |
| Na | 2Na+Br2=2NaBr | |
| H2 | H2+Br2=2HBr | |
| H2O | H2O+Br2?HBr+HBrO | |
| Kl | 2Kl+Br2=I2+2KBr |
分析 (1)卤素原子间可以形成卤素互化物,非金属性强的在互化物中显正价;
(2)Na和ICl反应与溴单质与钠反应相似生成NaI、NaCl;氢气和ICl反应生成HI、HCl;ICl和水反应生成HIO和HCl;ICl和KI反应生成I2和KI;
(3)根据分子晶体熔沸点与其相对分子质量的关系解答;分子晶体的熔沸点随分子量的增大而升高;
解答 解:(1)卤素原子间可以形成卤素互化物,非金属性强的在互化物中显正价,图表中原子间形成共价键时碘原子和氯原子间形成共价键,化合物A是形成卤素互化物ICl,
故答案为:ICl;
(2)Na和ICl反应与溴单质与钠反应相似生成NaI、NaCl,反应的化学方程式为:2Na+ICl=NaI+NaCl;氢气和ICl反应生成HI、HCl,反应的化学方程式为:H2+ICl=HCl+HI;ICl和水反应生成HIO和HCl,反应的化学方程式为:ICl+H2O=HIO+HCl;ICl和KI反应生成I2和KI,反应的化学方程式为:ICl+KI=I2+KCl,
故答案为:
| 反应物 | 化合物(A) | |
| Na | 2Na+ICl=NaI+NaCl | |
| H2 | H2+ICl=HCl+HI | |
| H2O | ICl+H2O=HIO+HCl | |
| Kl | ICl+KI=I2+KCl |
故答案为:分子晶体的熔沸点随分子量的增大而升高;Br2<ICl<IBr;
点评 本题考查了XX’型卤素互化物的性质及分子晶体熔沸点的特点等知识点,根据题给选项采用知识迁移的方法进行分析解答,题目难度中等.

练习册系列答案
相关题目
19.现有物质的量浓度均为 0.1mol•L -1 的下列五种物质的溶液:
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
①HCl ②H2SO4 ③CH3COOH ④NH4Cl ⑤NaOH.
下列有关说法正确的是( )
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
1.X、Y、Z为三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应X+2Y?2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
| A. | $\frac{ab}{5}$×100% | B. | $\frac{2ab}{5}$×100% | C. | $\frac{2ab}{5b}$×100% | D. | $\frac{ab}{5a}$×100% |