题目内容
14. 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:(1)应用托盘天平称取氢氧化钠固体的质量为1.0g(保留一位小数).
如图仪器的名称为容量瓶,使用此仪器前要检查它是否漏水.
(2)转移溶液时,应将已冷却的NaOH溶液沿玻璃棒(填仪器名称)注入右图所示的仪器中,并将洗涤液移入其中.加水,直到液面接近刻度线1~2cm时,改用胶头滴管(填仪器名称)小心地加水至溶液凹液面与刻度线相切.
(3)若称量前NaOH已部分潮解,则配制的溶液的浓度 偏小(填偏大或偏小).
(4)配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果偏低;
所用容量瓶未干燥,则结果不变;
定容时俯视,则结果偏高.
分析 (1)依据m=CVM计算需要溶质的质量;依据图象仪器说出其名称;容量瓶带有活塞,为防止使用过程中漏水使用前应检查是否漏水;
(2)依据移液、定容的正确操作解答;
(3)若称量前NaOH已部分潮解,导致称取的固体中含有氢氧化钠质量偏小,依据C=$\frac{n}{V}$进行误差分析;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制 250mL0.1mol/L的NaOH溶液,需要溶质的质量m=0.1mol/L×0.25L×40g/mol=1.0g;依据图象仪器可知仪器为容量瓶;容量瓶带有活塞,为防止使用过程中漏水使用前应检查是否漏水;
故答案为:1.0;容量瓶;漏液;
(2)移液时应用玻璃棒引流,定容的正确操作为:加水,直到液面接近刻度线1~2cm时,改用胶头滴管小心地加水至溶液凹液面与刻度线相切;
故答案为:玻璃棒;1~2;胶头滴管;
(3)若称量前NaOH已部分潮解,导致称取的固体中含有氢氧化钠质量偏小,依据C=$\frac{n}{V}$可知溶液浓度偏低;
故答案为:偏小;
(4)转移时未洗涤烧杯,导致溶质的物质的量偏小,则结果偏低;
所用容量瓶未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,则结果不变;
定容时俯视,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏低;不变;偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意误差分析的方法,题目难度不大.

练习册系列答案
相关题目
4.(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒.
(2)量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是B.
A.50mL 0.50mol•L-1 NaOH溶液 B.50mL 0.55mol•L-1 NaOH溶液
C.1.0g NaOH固体
(3)实验时大烧杯上若不盖硬纸板,求得的中和热数值偏小(填偏大、偏小、无影响)
(4)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
①设充分反应后溶液的比热容c=4.18J/(g•℃),忽略实验仪器的比热容及溶液体积的变化,则△H1=-56.8kJ/mol;△H2=-52.7kJ/mol.(已知溶液密度 均为1g/cm3)
②△H1≠△H2原因是NaOH是强碱,NH3•H2O是弱碱电离吸热.
(2)量取反应物时,取50mL 0.50mol•L-1的盐酸,还需加入的试剂是B.
A.50mL 0.50mol•L-1 NaOH溶液 B.50mL 0.55mol•L-1 NaOH溶液
C.1.0g NaOH固体
(3)实验时大烧杯上若不盖硬纸板,求得的中和热数值偏小(填偏大、偏小、无影响)
(4)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如表所示.
| 反应物 | 起始温度t1/℃ | 终了温度t2/℃ | 中和热/kJ•mol-1 |
| A.1.0mol/L HCl溶液50mL、1.1mol/L NaOH溶液50mL | 13.0 | 19.8℃ | △H1 |
| B.1.0mol/L HCl溶液50mL、1.1mol/L NH3•H2O溶液50mL | 13.0 | 19.3℃ | △H2 |
②△H1≠△H2原因是NaOH是强碱,NH3•H2O是弱碱电离吸热.
6.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强.下列说法正确的是( )
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
3.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ•mol-1.
(1)在绝热固定容积的密闭容器发生反应:N2(g)+3H2(g)?2NH3(g),能说明上述反应向正反应方向移动的是②④
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H的同时生成2n mol H-H
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为27.78KJ
②0~l小时内N2的平均反应速率0.05mol•L-1•h-1;
③此条件下该反应的化学平衡常数K=0.15(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”、“逆反应”或“不移动”).
(1)在绝热固定容积的密闭容器发生反应:N2(g)+3H2(g)?2NH3(g),能说明上述反应向正反应方向移动的是②④
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N-H的同时生成2n mol H-H
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④混合气体的平均摩尔质量增大
⑤容器内气体密度不变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为27.78KJ
②0~l小时内N2的平均反应速率0.05mol•L-1•h-1;
③此条件下该反应的化学平衡常数K=0.15(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向正反应方向移动(填“正反应”、“逆反应”或“不移动”).
4.下列说法正确的是( )
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白: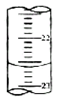 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.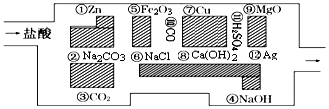
 .其中氧化剂是HCl,还原剂是Zn.
.其中氧化剂是HCl,还原剂是Zn.