题目内容
6.短周期主族元素X、Y、Z、W的原子序数依次增大.X原子最外层比次外层多3个电子;Y、Z均为金属,Y是同周期中原子半径最大的元素,Z的简单离子半径在同周期元素中最小;W的最高价氧化物在无机含氧酸中酸性最强.下列说法正确的是( )| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大.X原子最外层比次外层多3个电子,则X为N元素;Y、Z均为金属,Y是同周期中原子半径最大的元素,Y为Na元素,Z的简单离子半径在同周期元素中最小,Z为Al元素;W的最高价氧化物在无机含氧酸中酸性最强,W为Cl元素,以此来解答.
解答 解:由上述分析可知,X为N,Y为Na,Z为Al,W为Cl,
A.非金属性越强,对应氢化物越稳定,则X的气态氢化物的热稳定性比O(氧)的弱,故A错误;
B.元素Z、W的简单离子具有相同的电子层结构不同,分别为10电子、18电子结构,故B错误;
C.Z的氢氧化物具有两性,与NaOH、高氯酸均反应,则Y、Z、W的最高价氧化物对应的水化物之间能相互反应,故C正确;
D.等质量的Y和Z单质分别与足量稀盐酸反应,由$\frac{m}{23}$、$\frac{m}{27}$×3可知,转移电子不同,后者生成氢气多,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识及元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
11.将石墨置于熔融的钾中,石墨会吸收钾而形成称为钾石墨的物质,其组成是C8K、C24K、C36K、C48K和C60K.在钾石墨中,钾元素处于石墨中间层,因而石墨层之间被胀大,层间距离增大,钾原子把最外层电子交给石墨层但在遇到与金属钾易反应的其它物质时还会收回.下列对钾石墨的叙述正确的是( )
| A. | 钾石墨是一类共价化合物 | B. | 钾石墨导电性比石墨强 | ||
| C. | 钾石墨遇水不产生氢气 | D. | C8K、C24K和C36K属于同素异形体 |
18.已知:热化学方程式:
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
15.SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
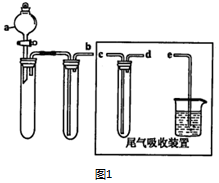
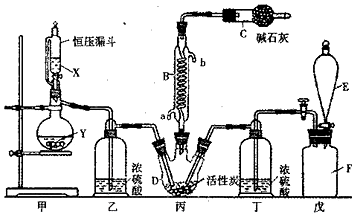
(1)某兴趣小组采用如图1所示装置制取SOz
①下列实验方案适用如图所示装置制取所需SO2的试剂是B(填序号).
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸
②a的仪器名称是分液漏斗.
③尾气吸收装置的连接顺序是b接d接c接e.
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)
吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(MnSO4•H2O)生产流程,其流程示意图如图2:
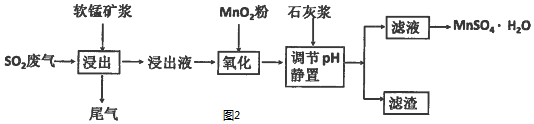
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H +.
②浸出过程中主要反应的化学方程式是SO2+MnO2=MnSO4.
③氧化过程中加入MnO2粉的目的是将Fe2+氧化为Fe3+;
反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
④用石灰浆调节pH,pH应调节的范围是4.7≤pH<8.3.
⑤滤渣的主要成分是氢氧化铁、氢氧化铝、硫酸钙.

(1)某兴趣小组采用如图1所示装置制取SOz
①下列实验方案适用如图所示装置制取所需SO2的试剂是B(填序号).
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸
②a的仪器名称是分液漏斗.
③尾气吸收装置的连接顺序是b接d接c接e.
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)
吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(MnSO4•H2O)生产流程,其流程示意图如图2:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H +.
②浸出过程中主要反应的化学方程式是SO2+MnO2=MnSO4.
③氧化过程中加入MnO2粉的目的是将Fe2+氧化为Fe3+;
反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
④用石灰浆调节pH,pH应调节的范围是4.7≤pH<8.3.
⑤滤渣的主要成分是氢氧化铁、氢氧化铝、硫酸钙.




 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题: