��Ŀ����
3����ҵ�Ϻϳɰ��ķ�Ӧ�ǣ�N2��g��+3H2��g��?2NH3��g����H=-92.20kJ•mol-1����1���ھ��ȹ̶��ݻ����ܱ�����������Ӧ��N2��g��+3H2��g��?2NH3��g������˵��������Ӧ������Ӧ�����ƶ����Ǣڢ�
�ٵ�λʱ��������2n mol NH3��ͬʱ����3n mol H2
�ڵ�λʱ��������6n mol N-H��ͬʱ����2n mol H-H
����N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2
�ܻ�������ƽ��Ħ����������
�������������ܶȲ���
��2����֪�ϳɰ���Ӧ��ij�¶���2L���ܱ������н��У�����������ݣ�
| ʱ�䣨h�� ���ʵ�����mol�� | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
�ٷ�Ӧ���е�2Сʱʱ�ų�������Ϊ27.78KJ
��0��lСʱ��N2��ƽ����Ӧ����0.05mol•L-1•h-1��
�۴������¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=0.15��������λС����
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2��NH3��1.00mol����ѧƽ�⽫������Ӧ�����ƶ��������Ӧ�������淴Ӧ�����ƶ�������
���� ��1���ٵ�λʱ��������2n mol NH3��Ч������3n mol H2��ͬʱ����3n mol H2����Ӧ��ƽ��״̬��
�ڵ�λʱ��������6n mol N-H��Ч������3n mol H-H��ͬʱ����2n mol H-H������ƽ��������Ӧ����
��ֻҪ��Ӧ������������N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2��
�ܻ�������ƽ��Ħ����������˵����������ʵ������ӣ�
��������������ܶ�һֱ���䣻
��2�������ݷ�Ӧ���ʱ��ϻ�ѧ����ʽ����ų���������
�ڸ��ݰ��������ʵ�����������ĵĵ��������ʵ������ٸ���v=$\frac{��c}{��t}$�����0��1Сʱ��N2��ƽ����Ӧ�ٶ��ʣ�
�۸���3��4Сʱ��ʱ��ΰ��������ʵ������䣬˵���ﵽ��ƽ��״̬�����ݰ��������ʵ�����������ĵĵ��������������ʵ�����ƽ��ʱ��Ũ�ȣ�
�ٸ���ƽ�ⳣ������ʽK=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}��•{c}^{3}��{H}_{2}��}$��������¶��µ�ƽ�ⳣ����
�ܸ��ݼ��백����ˮ�Ͱ������Ũ�����ж�ƽ���ƶ�����
��� �⣨1���ٵ�λʱ��������2n mol NH3��Ч������3n mol H2��ͬʱ����3n mol H2����Ӧ��ƽ��״̬���ʲ�ѡ��
�ڵ�λʱ��������6n mol N-H��Ч������3n mol H-H��ͬʱ����2n mol H-H������ƽ��������Ӧ����ѡ��
��ֻҪ��Ӧ������������N2��H2��NH3�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ����֮��Ϊ1��3��2���ʲ�ѡ��
�ܻ�������ƽ��Ħ����������˵����������ʵ������ӣ�ƽ�������ƶ�����ѡ��
��������������ܶ�һֱ���䣬�ʲ�ѡ��
�ʴ�Ϊ���ڢܣ���
��2����N2��g��+3H2��g��?2NH3��g����H=-92.20kJ•mol-1������2mol��������92.30kJ����Ӧ���е�2Сʱʱ�����������ʵ����仯��1.5mol-1.2mol=0.3mol�������ɰ���0.6mol���ų�������Ϊ$\frac{92.60}{2}$kJ/mol��0.6mol=27.78kJ��
�ʴ�Ϊ��27.78��
��0��1Сʱ��������0.2mol���������ݷ�ӦN2��g��+3H2��g��?2NH3��g���������˵��������ʵ���Ϊ��n��N2��=$\frac{1}{2}$n��NH3��=0.1mol��0��1Сʱ��N2��ƽ����Ӧ�ٶ���Ϊ��v��N2��=$\frac{\frac{0.1mol}{2L}}{1h}$=0.05mol/��L•h����
�ʴ�Ϊ��0.05��
�۸��ݱ������ݿ�֪����Ӧ�ڵ�3��4Сʱʱ����ڰ��������ʵ������䣬˵���ﵽ��ƽ��״̬����ʱ������1.00mol������
�г���ѧƽ�������ʽΪ N2��g��+3H2��g��?2NH3��g����
��Ӧ��ʼǰ��mol�� 1.5 4.5 0
�仯����mol�� 0.5 1.5 1
ƽ��ʱ��mol�� 1 3 1
ƽ��ʱŨ�ȣ�mol/L�� 0.500 1.500 0.5
���¶��¸÷�Ӧ�Ļ�ѧƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{0��{5}^{2}}{1��{5}^{3}��0.5}$��0.15��
�ʴ�Ϊ��0.15��
�ܷ�Ӧ�ﵽƽ�������ƽ����ϵ���ټ���N2��H2O��NH3��1mol����ʱ����ֵ�Ũ��Ϊ��
c��N2��=$\frac{1.00mol+1.00mol}{2L}$=1.00mol/L��c��H2��=$\frac{3.00mol+1.00mol}{2L}$=2.00mol/L��c��N2��=$\frac{1.00mol+1.00mol}{2L}$=1.00mol/L��
Ũ����Ϊ��$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}��•{c}^{3}��{H}_{2}��}$=$\frac{{1}^{2}}{{2}^{3}��1}$=0.125��k=0.15������ƽ�����������ƶ���
�ʴ�Ϊ������Ӧ��
���� ���⿼���˻�ѧƽ��״̬���жϡ���Ӧ�ȵļ��㡢��ѧƽ�ⳣ���ļ�����Ӧ�á���ѧ��Ӧ�����뻯ѧ�������Ĺ�ϵ��֪ʶ���漰��֪ʶ��϶࣬�����ۺ���ǿ���ѶȽϴ�����������ѧ������˼ά�����ͷ�ɢ˼ά���������ѧ����Ӧ��������ѧϰЧ�ʣ�

| A�� | ��ʯī��һ��ۻ����� | B�� | ��ʯī�����Ա�ʯīǿ | ||
| C�� | ��ʯī��ˮ���������� | D�� | C8K��C24K��C36K����ͬ�������� |
Zn��s��+$\frac{1}{2}$O2��g���TZnO��s����H=-351.1kJ•mol-1
2Hg��l��+O2��g���T2HgO��s����H=-181.4kJ•mol-1
�ɴ˿�֪Zn��s��+HgO��s���TZnO��s��+Hg��l����H=____��������
| A�� | -441.8kJ•mol-1 | B�� | -254.8kJ•mol-1 | C�� | -438.9kJ•mol-1 | D�� | -260.4kJ•mol-1 |
| A�� | ����ʱ��ij��Һ����ˮ���������c��H+����c��OH-���ij˻�Ϊl��10-24������Һ��һ�����Դ�������K+��Na+��AlO-2��SO2-4 | |
| B�� | 1 mol Na2O��Na2O2�����������������������3NA | |
| C�� | ���ӿɳ�������ִ��������й㷺Ӧ�ã����ij�ŵ練Ӧ����ʽ���У�Cd��OH��2+2Ni��OH��2$?_{�ŵ�}^{���}$Cd��OH��2+2Ni��OH��2+2H2O�����ʱ������ӦΪ��Ni��OH��2+OH-+e-�TNiO��OH��+H2O | |
| D�� | ijһ��Ӧ��ϵ�е������У�HCl��SnCl2��H2SnCl6��As��H3AsO3��H2O����֪As�Dz���֮һ����÷�Ӧ��ƽ��H2O�Ļ�ѧ������Ϊ6 |
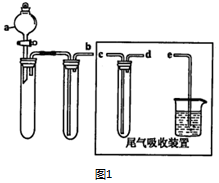
��1��ij��ȤС�������ͼ1��ʾװ����ȡSOz
������ʵ�鷽��������ͼ��ʾװ����ȡ����SO2���Լ���B������ţ���
A��Na2SO3��Һ��ϡ����
B��Na2SO3������Ũ����
C�������������
D��ͭ��Ũ����
��a�����������Ƿ�Һ©����
��β������װ�õ�����˳����b��d��c��e��
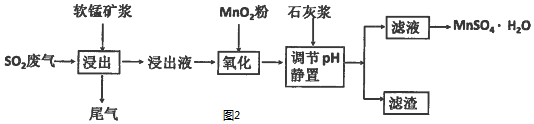
��2��Ϊ�˻�������SO2�������о���Ա���������õ�Ʒλ���̿���Ҫ�ɷ���MnO2��
���ո��±��պ������������SO2�������Ʊ������̾��壨MnSO4•H2O���������̣�������ʾ��ͼ��ͼ2��
��֪������Һ��pH��2�����еĽ���������Ҫ��Mn2+��������������Fe2+��Al3+�������������ӣ��йؽ��������γ������������ʱ��Һ��pH���±���
| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
�ٺ�Al3+���γ�������ˮ���������ӷ���ʽ��ʾ�侻ˮԭ��Al3++3H2O?Al��OH��3�����壩+3H +��
�ڽ�����������Ҫ��Ӧ�Ļ�ѧ����ʽ��SO2+MnO2=MnSO4��
�����������м���MnO2�۵�Ŀ���ǽ�Fe2+����ΪFe3+��
��Ӧ�����ӷ���ʽ��2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O��
����ʯ�ҽ�����pH��pHӦ���ڵķ�Χ��4.7��pH��8.3��
����������Ҫ�ɷ���������������������������ƣ�
| ѡ�� | ʵ�� | ���� | ���� |
| A | ������KMnO4��Һ�еμ�H2O2��Һ������ | ��ɫ��ʧ | H2O2�ڸ÷�Ӧ������ԭ�� |
| B | ����SO2��BaCl2��Һ��ͨ������X | �а�ɫ�������� | Xһ����Cl2 |
| C | ��FeBr2��KSCN�����Һ�е�������������ˮ���ټ���CCl4��������� | �л���ʺ���ɫ��ˮ�����ɫ | Fe2+�Ļ�ԭ�Դ���Br- |
| D | ��˿��ɰֽ��ĥ�������Ũ�����н���һ��ʱ�����CuSO4��Һ�� | ��˿������ɫ | ���ɴ�ͭ����Һ���û���ͭ |
| A�� | A | B�� | B | C�� | C | D�� | D |
 ������ 250mL0.1mol/L��NaOH��Һ���ش������й����⣺
������ 250mL0.1mol/L��NaOH��Һ���ش������й����⣺ ��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�
��Դ����Լ���ҷ�չ���̵�����֮һ���״��������ѵȱ���Ϊ2 1���͵���ɫ��Դ����ҵ��������Ȼ��Ϊ��Ҫԭ���������̼��ˮ������һ���������Ʊ��ϳ�����CO��H2�������Ƴɼ״��������ѣ�