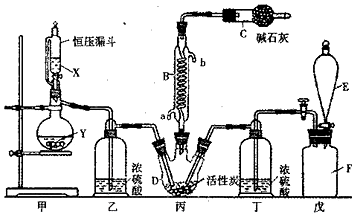
题目内容
9.已知31.6g的KMnO4与过量的浓盐酸完全反应,化学方程式为:KMnO4+HCl═KCl+MnCl2+Cl2↑+H2O,回答下列问题:(1)写出配平后的正确化学方程式.
(2)指出该反应中盐酸的作用?
(3)氧化剂与还原剂的物质的量之比是多少?
(4)产生的Cl2在标准状况下的体积是多少?(要有必要解题过程)
分析 (1)Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,失去的电子为5×2×(1-0)e-=10e-,由此配平反应方程式;
(2)反应中盐酸中的氯的化合价部分变,所以盐酸既有酸性又有还原性;
(3)由反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,高锰酸钾是氧化剂,氯化氢是还原剂,氧化剂与还原剂的物质的量之比2:10;
(4)根据V=nVm计算求解.
解答 解:(1)Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,失去的电子为5×2×(1-0)e-=10e-,配平反应方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,答:配平后的正确化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;
(2)反应中盐酸中的氯的化合价部分变,所以盐酸既有酸性又有还原性,答:反应中盐酸的作用是酸性和还原性;
(3)由反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,高锰酸钾是氧化剂,氯化氢是还原剂,氧化剂与还原剂的物质的量之比2:10=1:5,答:氧化剂与还原剂的物质的量之比为1:5;
(4)n(KMnO4)=$\frac{31.6g}{158g/mol}$=0.2mol,由2KMnO4~5Cl2,所以n(Cl2)=0.2mol×2.5=0.5mol,则V(Cl2)=0.5mol×22.4L/mol=11.2L,
答:产生的Cl2在标准状况下的体积是11.2L.
点评 本题考查学生氧化还原反应中电子转移和化学方程式的计算等方面知识,为高频考点,侧重于学生的分析、计算能力的考查,注意知识的归纳和整理,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| A. | 试管 | B. | 蒸发皿 | C. | 坩埚 | D. | 烧杯 |
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |
 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题: