题目内容
5. 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:(1)写出化学式:ANa、BNa2O2、CNaOH、DNa2CO3.
(2)写出物质B的用途供氧剂.
(3)写出A→C反应的离子方程式2Na+2H2O═2Na++2OH-+H2↑;B→D反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
(4)向饱和Na2CO3溶液中通入足量CO2,现象是有白色晶体析出.
分析 A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,结合题目分析解答.
解答 解:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
(1)通过以上分析知,A、B、C、D分别是Na、Na2O2、NaOH、Na2CO3,
故答案为:Na;Na2O2;NaOH;Na2CO3;
(2)B是过氧化钠,能和水、二氧化碳反应生成氧气,所以可以作供氧剂,故答案为:供氧剂;
(3)钠和水反应生成氢氧化钠和氢气,过氧化钠和二氧化碳反应生成碳酸钠和氧气,反应方程式分别为2Na+2H2O═2Na++2OH-+H2↑、2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;2Na2O2+2CO2=2Na2CO3+O2;
(4)碳酸钠溶解度大于碳酸氢钠,向饱和碳酸钠溶液中通入过量二氧化碳生成碳酸氢钠,导致溶液为过饱和溶液,则有碳酸氢钠晶体析出,故答案为:有白色晶体析出.
点评 本题以钠及其化合物之间的转化为载体考查无机物推断,侧重考查学生分析推断能力,涉及物质推断、离子方程式书写、物质用途等知识点,明确元素化合物的性质及物质之间的转化是解本题关键,注意基础知识的积累.

练习册系列答案
相关题目
20.下列仪器不宜直接用于加热的是( )
| A. | 试管 | B. | 蒸发皿 | C. | 坩埚 | D. | 烧杯 |
10.如图所示的实验,能达到实验目的或说法正确的是( )
| A. | 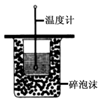 进行中和热的测定 | |
| B. | 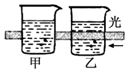 运用该实验可区分胶体和溶液 | |
| C. | 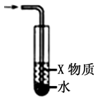 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
15.SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
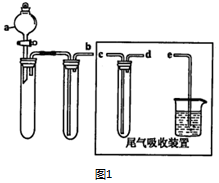
(1)某兴趣小组采用如图1所示装置制取SOz
①下列实验方案适用如图所示装置制取所需SO2的试剂是B(填序号).
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸
②a的仪器名称是分液漏斗.
③尾气吸收装置的连接顺序是b接d接c接e.
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)
吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(MnSO4•H2O)生产流程,其流程示意图如图2:
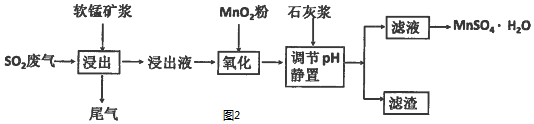
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
请回答:
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H +.
②浸出过程中主要反应的化学方程式是SO2+MnO2=MnSO4.
③氧化过程中加入MnO2粉的目的是将Fe2+氧化为Fe3+;
反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
④用石灰浆调节pH,pH应调节的范围是4.7≤pH<8.3.
⑤滤渣的主要成分是氢氧化铁、氢氧化铝、硫酸钙.

(1)某兴趣小组采用如图1所示装置制取SOz
①下列实验方案适用如图所示装置制取所需SO2的试剂是B(填序号).
A.Na2SO3溶液与稀硝酸
B.Na2SO3固体与浓硫酸
C.固体硫和氧气
D.铜与浓硫酸
②a的仪器名称是分液漏斗.
③尾气吸收装置的连接顺序是b接d接c接e.
(2)为了回收利用SO2废气,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)
吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体(MnSO4•H2O)生产流程,其流程示意图如图2:

已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
①含Al3+的盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O?Al(OH)3(胶体)+3H +.
②浸出过程中主要反应的化学方程式是SO2+MnO2=MnSO4.
③氧化过程中加入MnO2粉的目的是将Fe2+氧化为Fe3+;
反应的离子方程式是2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
④用石灰浆调节pH,pH应调节的范围是4.7≤pH<8.3.
⑤滤渣的主要成分是氢氧化铁、氢氧化铝、硫酸钙.





 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题: