题目内容
2. 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.Ⅰ:常温下,分析下列情况问题
(1)将等体积、等物质的量浓度的盐酸与氢氧化钠溶液混合后,溶液中离子浓度由大到小的顺序c(Cl?)=c(Na+)>c(H+)=c(OH?).
(2)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,m与n的大小关系是m大于n. (填“大于”、“小于”或“等于”.)
(3)PH值为3的CH3COOH 溶液与PH值为11的NaOH 溶液等体积混合后,溶液呈酸性.(填“酸性”、“中性”或“碱性”.)
(4)CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,当加入氨水的体积为10mL时,c(NH4+)小于0.05mol/L,c(CH3COO-)等于c(NH4+)(填“大于”、“小于”或“等于”.)
Ⅱ:某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.向洗净后的锥形瓶中放入15.00mL溶液.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程2-3次.试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由红色变为无色
(2)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化;
(3)该小组在步骤②中的错误造成的测定结果偏高 (填偏高、偏低或无影响);
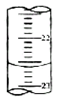
(4)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL.
分析 I.(1)将等体积、等物质的量浓度的盐酸与氢氧化钠溶液混合后,生成NaCl溶液,溶液显中性;
(2)醋酸为弱电解质,溶液中部分电离出氢离子,等体积的两溶液混合pH=7,溶液显示中性,若二者恰好反应生成醋酸钠溶液显碱性;
(3)醋酸溶液中醋酸的浓度大于氢离子浓度,氢氧化钠溶液中氢氧化钠的浓度等于氢氧根离子的浓度,等体积混合后,醋酸过量;
(4)CH3COOH和NH3•H2O的电离常数相等,氨水与醋酸的浓度、体积相等时,溶液显示中性;
II.(1)根据滴定终点,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,应停止滴定;
(2)根据滴定时眼睛应观察锥形瓶内溶液颜色的变化;
(3)锥形瓶用蒸馏水洗净即可,不能用待测溶液润洗,否则,待测溶液偏多,导致结果偏高;
(4)读数时目光平视,凹液面最低点与刻度线相切.
解答 解:I.(1)将等体积、等物质的量浓度的盐酸与氢氧化钠溶液混合后,生成NaCl溶液,溶液显中性,溶液中离子浓度大小关系为:c(Cl?)=c(Na+)>c(H+)=c(OH?);
故答案为:c(Cl?)=c(Na+)>c(H+)=c(OH?);
(2)醋酸为弱电解质,溶液中部分电离出氢离子,等体积的两溶液混合pH=7,溶液显示中性,若二者恰好反应生成醋酸钠溶液显碱性,若溶液显中性,则醋酸稍过量,即m大于n;
故答案为:大于;
(3)醋酸溶液中醋酸的浓度大于氢离子浓度,氢氧化钠溶液中氢氧化钠的浓度等于氢氧根离子的浓度,PH值为3的CH3COOH 溶液与PH值为11的NaOH 溶液等体积混合后,醋酸过量,溶液显酸性;
故答案为:酸性;
(4)当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),由于NH4+会发生水解,所以c(NH4+) 小于0.05mol/L;
故答案为:小于;等于;
II.(1)因滴定终点时,锥形瓶中的溶液从红色变为无色时,且半分钟内不褪色,停止滴定,
故答案为:红色变为无色;
(2)滴定时眼睛应观察锥形瓶内溶液颜色的变化,以判定终点的到达,
故答案为:锥形瓶内溶液颜色的变化;
(3)锥形瓶用蒸馏水洗净即可,不能用待测溶液润洗,否则,待测溶液偏多,所以消耗标准液的体积偏大,根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$可知,c(待测)偏高;
故答案为:偏高;
(4)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60,
故答案为:22.60.
点评 本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系、酸碱中和滴定的操作、误差分析,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确溶液中电荷守恒、物料守恒、盐的水解比较溶液中离子浓度大小的方法、掌握中和滴定的原理是解题的关键.

| A. | 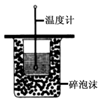 进行中和热的测定 | |
| B. | 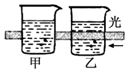 运用该实验可区分胶体和溶液 | |
| C. | 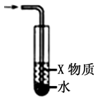 X若为苯,可用于吸收NH3或HCl,并防止倒吸 | |
| D. |  验证AgCl溶解度大于Ag2S |
| A. | 钾石墨是一类共价化合物 | B. | 钾石墨导电性比石墨强 | ||
| C. | 钾石墨遇水不产生氢气 | D. | C8K、C24K和C36K属于同素异形体 |
| 选项 | 实验 | 现象 | 结论 |
| A | 向酸性KMnO4溶液中滴加H2O2溶液至过量 | 紫色消失 | H2O2在该反应中作还原剂 |
| B | 溶有SO2的BaCl2溶液中通入气体X | 有白色沉淀生成 | X一定是Cl2 |
| C | 向FeBr2和KSCN混合溶液中滴入少量新制氯水,再加入CCl4混合振荡、静置 | 有机相呈红棕色,水相呈无色 | Fe2+的还原性大于Br- |
| D | 铝丝用砂纸打磨后,放在冷的浓硝酸中浸泡一段时间后,放入CuSO4溶液中 | 铝丝表面变红色 | 铝可从铜盐溶液中置换出铜 |
| A. | A | B. | B | C. | C | D. | D |
 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
 欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题:
欲配制 250mL0.1mol/L的NaOH溶液,回答下列有关问题: