题目内容
19.Na2O2是一种常见的过氧化物,具有强氧化性和漂白性.通常可用作漂白剂和呼吸面具中的供氧剂.
(1)某实验小组通过下列实验(图1)探究过氧化钠与水的反应:
①用化学方程式解释使酚酞试液变红的原因2Na2O2+2H2O=4NaOH+O2↑,依据实验现象推测红色褪去的原因是反应生成的H2O2具有漂白作用.
②加入MnO2反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)实验小组两名同学共同设计如图2装置探究过氧化钠与二氧化硫的反应.通入SO2,将带余烬的木条插入试管C中,木条复燃.
请回答下列问题:
①甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:2Na2O2+2SO2=2Na2SO3+O2,检验反应后B中的白色固体含有Na2SO3的方法是:取反应生成白色固体少许,滴入稀硫酸,生成无色气体使品红溶液褪色,说明含Na2SO3.
②乙同学认为反应的后B中有Na2SO3还会有Na2SO4.乙同学猜想的理由是:过氧化钠具有强氧化性,二氧化硫有较强的还原性.为检验产物中Na2SO4的存在乙同学设计并实施了如图3实验方案:
甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为稀硝酸能将亚硫酸钡氧化为硫酸钡.
③请补充完整实验小组测定B中反应完全后固体组成的实验方案.称取样品a 克加水溶解,加盐酸酸化的氯化钡溶液,过滤,洗涤,烘干,称量沉淀质量为b 克,计算含量.
分析 (1)①过氧化钠和水反应生成氢氧化钠是碱,碱遇酚酞变红;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性;
②过氧化氢在二氧化锰做催化剂分解生成水和氧气;
(2)①根据反应物和生成物写出方程式,根据得失电子数相等配平方程式;要证明白色固体中含有Na2SO3只需检验出含有SO32-就可以了;
②根据过氧化钠具有强氧化性,二氧化硫有较强的还原性,两者发生氧化还原反应生成Na2SO4;硫酸钠和亚硫酸钠均有氯化钡反应生成沉淀,亚硫酸钡加硝酸时氧化生成硫酸钡,不能说明是否含硫酸钡;
③利用亚硫酸钡易溶于盐酸,硫酸钡不溶分析判断.
解答 解:(1)①过氧化钠和水反应生成氢氧化钠是碱,碱遇酚酞变红,反应方程式为2Na2O2+2H2O=4NaOH+O2↑;红色褪去的可能原因是过氧化钠和水反应生成的过氧化氢具有氧化性,能氧化有色物质,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;反应生成的H2O2具有漂白作用;
②过氧化氢在二氧化锰做催化剂分解生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(2)①Na2O2与SO2反应生成了Na2SO3和O2,结合得失电子守恒知,该反应方程式为:2Na2O2+2SO2=2Na2SO3+O2,要证明白色固体中含有Na2SO3只需检验出含有SO32-就可以了,则取反应生成白色固体少许,滴入稀硫酸,生成无色气体使品红溶液褪色,说明含Na2SO3,
故答案为:2Na2O2+2SO2=2Na2SO3+O2;取反应生成白色固体少许,滴入稀硫酸,生成无色气体使品红溶液褪色,说明含Na2SO3;
②因为过氧化钠具有强氧化性,二氧化硫有较强的还原性,两者发生氧化还原反应生成Na2SO4;由实验流程可知,稀硝酸具有强氧化性,它也会将亚硫酸钡氧化为硫酸钡,最终也生成硫酸钡沉淀,则不能说明反应的后B中有Na2SO3还会有Na2SO4,
故答案为:过氧化钠具有强氧化性,二氧化硫有较强的还原性;稀硝酸能将亚硫酸钡氧化为硫酸钡;
③因为亚硫酸钡易溶于盐酸,硫酸钡不溶,所以测定B中反应完全后固体组成的实验方案为称取样品a 克加水溶解,加盐酸酸化的氯化钡溶液,过滤,洗涤烘干,称量沉淀质量为b 克,计算含量,故答案为:加盐酸酸化的氯化钡溶液,过滤,洗涤.
点评 本题考查性质实验方案的设计,综合考查物质的性质及实验能力,为高频考点,把握二氧化硫、过氧化钠及硝酸的性质及实验流程为解答的关键,题目难度不大.

| A. | 盐中一定含有金属元素 | B. | 氢化物一定是共价化合物 | ||
| C. | 碱中一定含有氢、氧元素 | D. | 能电离出H+的物质一定是酸 |
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
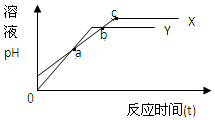 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )| A. | Y代表盐酸与镁条的反应 | B. | a点时反应Y消耗镁条的量少 | ||
| C. | b点表示此时两溶液pH相等 | D. | c点表示此时反应结束 |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
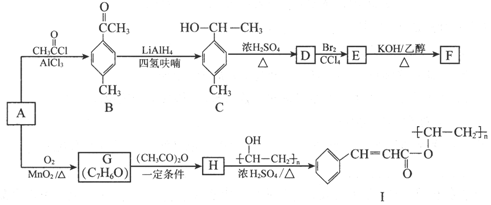
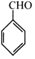
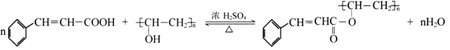
 (写出其中一种的结构简式).
(写出其中一种的结构简式).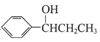 的合成路线
的合成路线 .
.