题目内容
11.分子式为C5H8O2,能使溴的CC14溶液褪色且分子中含有一个甲基的羧酸类物质共有(不含立体异构)( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
分析 分子式为C5H8O2,能使溴的CC14溶液褪色,说明此分子含有碳碳双键,且分子中含有一个甲基的羧酸类物质,说明此分子含有羧基,然后根据官能团的位置异构和碳链异构以及含有1个甲基确定.
解答 解:由该有机物的化学性质、组成知其含有碳碳双键、羧基.
当没有支链时,其碳骨架有3种:CH2=CHCH2CH2COOH,CH3CH=CHCH2COOH,CH3CH2CH=CHCOOH,但CH2=CHCH2CH2COOH分子中没有甲基,舍去;
有一个甲基做支链的结构有4种:CH2=CH(CH3)CH2COOH,CH2=CHCH(CH3)COOH,(CH3)2CH=CHCOOH,CH3CH=CH(CH3)COOH,但(CH3)2CH=CHCOOH,CH3CH=CH(CH3)COOH分子中有2个甲基,舍去;
有一个乙基做支链的结构有1种:CH2=C(CH2CH3)COOH,
所以符合题意的共有5种,故选B.
点评 本题主要考查同分异构体书写、官能团的性质与确定等,难度中等,掌握有机物的性质和同分异构体的书写规则是关键,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断试样的pH=4.
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表:
①计算上述反应T1℃时的平衡常数K1=4;
②若T1<T2,则该反应的△H_<0(填“>”、“<”或“=”).
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)汽车尾气中NOx和CO的生成:
①已知汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H>0恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是D
A.混合气体的密度不再变化 B.混合气体的平均相对分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的百分含量不再变化
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g),已知该反应的△H>0,则该设想能否实现不能(填“能”或“不能”)
(3)汽车尾气净化的主要原理:2NO(g)+2CO(g)$\frac{\underline{\;催化剂\;}}{\;}$2CO2(g)+N2(g);△H<0,若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填序号).(如图中v正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)

(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一.活性炭可处理大气污染物NO.在5L密闭容器中加入NO和活性炭(假设无杂质).一定条件下生成气体E和F.当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如表:
| 物质 温度/℃ | 活性炭 | NO | E | F |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
②若T1<T2,则该反应的△H_<0(填“>”、“<”或“=”).
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为80%.
2.铁及其化合物在工农业生产中有重要的作用.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.
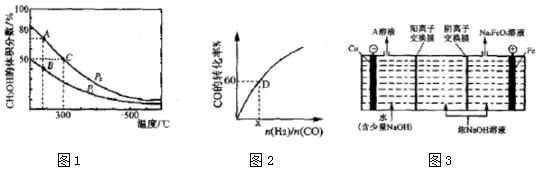
①在图1A、B、C三点中,选填表物理量对应最大的点.
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,该反应向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.

①在图1A、B、C三点中,选填表物理量对应最大的点.
| 反应速率v | 平衡常数K | 平衡转化率α |
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
6.X、Y、Z、W为短周期元素,X2-和Y+核外电子排布相同,X、Z位于同一主族,Z、W位于同一周期,W的最外层电子数是X、Y最外层电子数之和.下列说法不正确的是( )
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
16.下列关于实验现象的描述正确的是( )
| A. | 往碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向盛有1mLmol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀产生,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转变为红褐色 | |
| C. | 重铬酸钾酸性溶液中加入乙醇,溶液由墨绿色变为橙黄色 | |
| D. | 用石墨作电极电解CuCl2溶液可观察到阳极石墨棒上覆盖一层红色的铜,阴极石墨棒上生成能使湿润碘化钾淀粉试纸变蓝的气体 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L0.1mol•L-1NaHS溶液中,S2-与HS-数目之和为0.1NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 4gD2O与4gH218O含有的中子数均为2NA | |
| D. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
19.X、Y、Z、W是原子序数依次增大的短周期元素,其中X原子与Y原子可形成具有10个电子的M分子,Y元素最高价氧化物对应的水化物与M反应会生成一种离子化合物,Z元素原子的最外层电子数为2,W元素的单质可用于自来水的消毒杀菌.下列说法正确的是( )
| A. | 非金属性:Y>X>W | |
| B. | Z与W形成的化合物中存在共价键 | |
| C. | 一定条件下Z3Y2与水反应可生成M | |
| D. | 工业上用W单质与澄清石灰水反应制取漂白粉 |