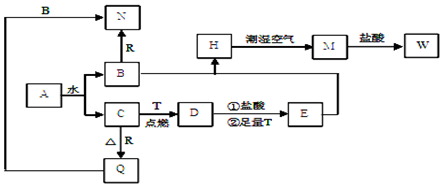
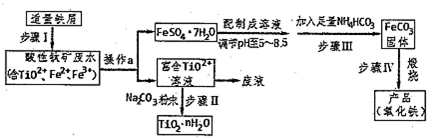
题目内容
14.对于下列实验事实的解释,不合理的是( )| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl易挥发,加热氯化镁溶液生成氢氧化镁;
B.得电子能力H+>Na+;
C.浓硝酸氧化NO,说明具有较强的氧化性;
D.羟基中氢的活性越强,越易与钠反应.
解答 解:A.HCl易挥发,加热氯化镁溶液生成氢氧化镁,因硫酸不挥发,加热蒸干MgSO4溶液能得到MgSO4固体,可知与酸的挥发性有关,故A正确;
B.得电子能力H+>Na+,解释不正确,故B错误;
C.浓硝酸氧化NO,而稀硝酸不反应,可说明浓硝酸具有较强的氧化性,故C正确;
D.羟基中氢的活性越强,越易与钠反应,钠与乙醇反应平缓;钠与水反应剧烈,可说明羟基中氢的活性:C2H5OH<H2O,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的性质、检验等知识,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
4. 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>(填“>”、“<”或“=”)1×10-14
(2)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.
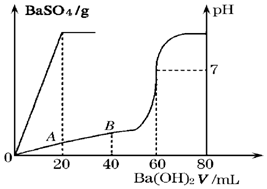
(3)25℃时,有盐酸和硫酸的混合液20mL,加入0.05mol•L-1的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液的pH发生如图所示的变化.
则①原混合液中硫酸和盐酸的物质的量浓度分别是:c(H2SO4)=0.05 mol•L-1;c(HCl)=0.2 mol•L-1
②在A点时的pH=1 (设溶液混合后体积不变)
 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>(填“>”、“<”或“=”)1×10-14
(2)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性.
(3)25℃时,有盐酸和硫酸的混合液20mL,加入0.05mol•L-1的Ba(OH)2溶液时,生成BaSO4沉淀量及溶液的pH发生如图所示的变化.
则①原混合液中硫酸和盐酸的物质的量浓度分别是:c(H2SO4)=0.05 mol•L-1;c(HCl)=0.2 mol•L-1
②在A点时的pH=1 (设溶液混合后体积不变)
2.铁及其化合物在工农业生产中有重要的作用.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.
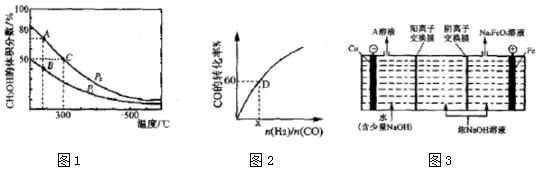
①在图1A、B、C三点中,选填表物理量对应最大的点.
②在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,该反应向正反应方向进行(填“正反应”、“逆反应”或“不移动”).
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
(1)已知:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
③4Fe(s)+3O3(g)=2Fe2O3 (s)△H3=-1651.0kJ•mol-1
CO还原氧化铁的热化学方程式为Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-23.5kJ.mol-1.
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理如下:CO(g)+2H2(g)?CH3OH(g)△H.在体积不同的两个恒容密闭容器中分别充入1molCO和2moL H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1.

①在图1A、B、C三点中,选填表物理量对应最大的点.
| 反应速率v | 平衡常数K | 平衡转化率α |
③一定温度下,CO的转化率与起始投料比[$\frac{n({H}_{2})}{n(CO)}$]的变化关系如图2所示,测得D点氢气的转化率为40%,则x=3.
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板.某腐蚀废液中含有 0.5mol•L-l Fe3+ 和0.26mol•L-1 的 Cu2+,欲使 Fe3+完全沉淀[c(Fe3+)<4×10-5 mol•L-1]而Cu2+不沉淀,则需控制溶液 pH 的范围为3≤pH<5.[KSp(Cu(OH)2=2.6×10-19;Ksp(Fe(OH)3=4×10-38;
(4)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,工业上通过电解浓 NaOH溶液可制备Na2FeO4,然后转化为K2FeO4,电解原理如图3所示.
则A溶液中溶质的成分为NaOH(填化学式);阳极的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O.
9.化学与生活、材料等密切相关,下列说法错误的是( )
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
6.X、Y、Z、W为短周期元素,X2-和Y+核外电子排布相同,X、Z位于同一主族,Z、W位于同一周期,W的最外层电子数是X、Y最外层电子数之和.下列说法不正确的是( )
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |