题目内容
19.下列物质中既含有离子键又含有极性键的是( )| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,故A正确;
B.NaCl中钠离子和氯离子之间只存在离子键,不含有极性键,故B错误;
C.O2分子中O-O原子之间只存在非极性键,不存在离子键,故C错误;
D.NH3中N-H原子之间只存在极性键,不存在离子键,故D错误;
故选A.
点评 本题考查化学键判断,侧重考查基本概念,题目难度不大,明确离子键和共价键的区别是解本题关键,熟悉常见物质中存在的化学键,试题有利于提高学生的分析能力就灵活应用基础知识的能力.

练习册系列答案
相关题目
9.在平衡体系N2+O2?2NO-Q中,能使氮的转化率提高的措施是( )
| A. | 通入N2 | B. | 加压 | ||
| C. | 升高温度 | D. | 使用合适的催化剂 |
7.一定条件下,密闭容器发生反应2SO2(g)+O2(g)?2SO3(g),生成2molSO3(g)时,放出QkJ热量,下列说法正确的是( )
| A. | 相同条件下,2molSO2(g)和1molO2(g)所具有的能量小于2molSO3(g)所具有的能量 | |
| B. | 当v(正)>v(逆)时,随着反应进行,反应物的物质的量减少 | |
| C. | 相同条件下,若用18O2与SO2(g)在密闭容器中反应,达平衡时,18O存在于二氧化硫、氧气、三氧化硫中 | |
| D. | 相同条件下,向密闭容器中加入2molSO2(g)和1molO2(g)充分反应后,放出的热量为QkJ |
4.燃料电池的基本组成为电极、电解质、燃料和氧化剂.此种电池的能量利用率可高达80%,产物污染也少.下列有关燃料电池说法错误的是( )
| A. | 氢氧燃料电池的电解质用KOH溶液时,其负极电极反应为2H2-4e-+4OH-═4H2O | |
| B. | 燃料电池负极燃料失电子,发生还原反应 | |
| C. | 碱性甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- | |
| D. | 除纯氧外,空气中的氧气也可以作氧化剂 |
11.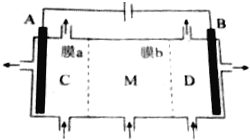 离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )
离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )
 离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )
离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )| A. | a膜为阳离子交换膜 | |
| B. | 溶液中SO${\;}_{3}^{2-}$由M室经b膜移向D室 | |
| C. | A极的电极反应式为SO${\;}_{3}^{2-}$+2e-+H2O═SO${\;}_{4}^{2-}$+2H+ | |
| D. | C室溶液呈酸性,M室溶液呈中性,D室溶液呈碱性 |
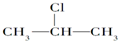 +NaOH$→_{醇}^{△}$CH3-CH=CH2+NaCl+H2O
+NaOH$→_{醇}^{△}$CH3-CH=CH2+NaCl+H2O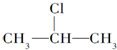 $→_{-NaCl,-H_{2}O}^{NaOH,△,醇}$CH3-CH=CH2
$→_{-NaCl,-H_{2}O}^{NaOH,△,醇}$CH3-CH=CH2
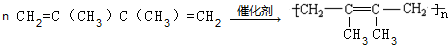 .
.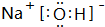 .
.