题目内容
4.燃料电池的基本组成为电极、电解质、燃料和氧化剂.此种电池的能量利用率可高达80%,产物污染也少.下列有关燃料电池说法错误的是( )| A. | 氢氧燃料电池的电解质用KOH溶液时,其负极电极反应为2H2-4e-+4OH-═4H2O | |
| B. | 燃料电池负极燃料失电子,发生还原反应 | |
| C. | 碱性甲烷燃料电池的正极反应为O2+2H2O+4e-═4OH- | |
| D. | 除纯氧外,空气中的氧气也可以作氧化剂 |
分析 A、燃料电池中负极上失电子发生氧化反应,负极上反应材料是燃料;
B、燃料电池中负极上失电子发生氧化反应;
C、燃料电池正极上氧气得电子发生还原反应;
D、氧气具有氧化性,常做氧化剂.
解答 解:A.氨气燃料电池中,燃料氨气做负极,负极反应为:2NH3-6e-+6OH-=N2+6H2O,故A正确;
B、燃料电池负极燃料失电子,发生氧化反应,故B错误;
C、碱性环境下,甲烷燃料电池中正极上电极反应式为:O2+2H2O+4e-=4OH-,故C正确;
D、氧气具有氧化性,常做氧化剂,可乙是纯氧,还可以是空气中的氧气,故D正确.
故选B.
点评 本题考查了原电池原理,明确正负极上得失电子即可解答,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写,为易错点.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
14.N2的结构可以表示为 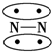 ,CO的结构可以表示为
,CO的结构可以表示为 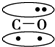 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为  ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
19.下列物质中既含有离子键又含有极性键的是( )
| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
16. 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:
(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
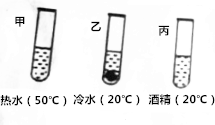
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
由图实验可知影响物质溶解性的因素有温度、溶剂的种类,实验中若将甲试管溶液降温至t1℃时,溶液恰好饱和,则t1℃时,X的溶解度时20g,若往甲中加入5g水,改变温度至t2℃时,溶液又恰好饱和,则t1>t2(填“>”“<”或“=”).
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
| 温度/℃ | 10 | 30 | 50 | 70 | |
| 溶解度/g | NaCl | 35.8 | 36.3 | 37.0 | 37.8 |
| KNO3 | 20.9 | 45.8 | 85.5 | 138 | |
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
8.已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子(H+)能力最强的是CO32-
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
(1)常温下,浓度均为0.1mol•L-1的下列五种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
②根据表中数据判断,浓度均为0.01mol•L-1的下列四种物质的溶液中,酸性最强的是C;
(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是A
A.HCN B.HClO C.H2CO3 D.CH3COOH
③根据上表数据,请计算0.1mol•L-1的NaCN溶液中水电离出的氢氧根离子的浓度10-3mol/L
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,请用平衡原理原因HClO和碳酸钠不反应,而盐酸和碳酸钠反应生成二氧化碳,所以导致氯水中HClO浓度增大2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO(写离子方程式并用必要的文章说明,否则0分).
(2)在0.1mol•L-1的NaClO溶液中,写出离子浓度的大小关系c(Na+)>c(ClO-)>c(OH-)>c(H+).
 人们对苯及芳香烃的认识是一个不断深化的过程.
人们对苯及芳香烃的认识是一个不断深化的过程. .
.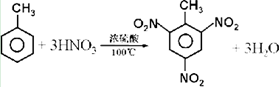 .
.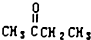 )、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.
)、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.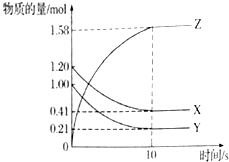 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,试回答下列问题:


