题目内容
9.在平衡体系N2+O2?2NO-Q中,能使氮的转化率提高的措施是( )| A. | 通入N2 | B. | 加压 | ||
| C. | 升高温度 | D. | 使用合适的催化剂 |
分析 A、通入一种物质,另一种物质的转化率升高,而本身的转化率降低;
B、两边气体计量数相等,所以加压平衡不移动;
C、升高温度平衡向吸热反应方向移动;
D、使用合适的催化剂,平衡不移动;
解答 解:A、通入一种物质,另一种物质的转化率升高,而本身的转化率降低,所以通入氮气,氧气的转化率升高,而氮气本身转化率降低,故A错误;
B、两边气体计量数相等,所以加压平衡不移动,氮气的转化率不变,故B错误;
C、升高温度平衡向吸热反应方向移动,所以平衡正向移动,则氮气转化率变大,故C正确;
D、使用合适的催化剂,平衡不移动,则氮气的转化率不变,故D错误;
故选C.
点评 本题考查化学平衡移动影响因素,比较基础,注意理解化学平衡移动原理.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
17.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数是NA | |
| B. | 常温常压下,NA个CO2占有的体积为22.4L | |
| C. | 1.06克Na2CO3含有Na+数为0.02NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA |
4.某电解质溶液中有有Na+、Mg2+、Cl-、SO42-,且Na+、Mg2+、Cl-的浓度分别为0.2mol/L、0.4mol/L、0.4mol/L,则SO42-的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
14.N2的结构可以表示为 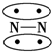 ,CO的结构可以表示为
,CO的结构可以表示为 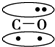 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为  ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有三键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
1.元素性质的周期性变化不包括( )
| A. | 原子半径 | B. | 元素的主要化合价 | ||
| C. | 相对原子质量 | D. | 金属性和非金属性 |
19.下列物质中既含有离子键又含有极性键的是( )
| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
 ,其中所含化学键的类型是共价键.
,其中所含化学键的类型是共价键.
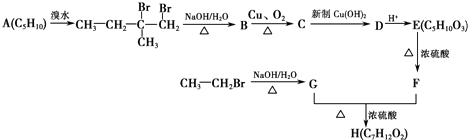
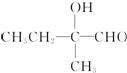 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$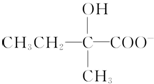 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.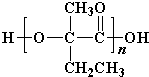 .
.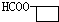 、
、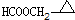 .
.