题目内容
4.有原子序数依次增大的五种短周期元素A、B、C、D、E,已知:A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物与其氢化物反应生成一种盐;A、B、C、E四种元素都能与D元素形成原子个数比不相同的多种常见化合物,回答下列问题:(1)B在周期表中的位置是第二周期IVA族,C元素单质的结构式为N≡N.
(1)写出含有A、D、E三种元素的化合物电子式是
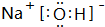 .
.(3)E与D形成的一种化合物与A2D发生氧化还原反应,该反应的化学方程式为2Na2O2+2H20=4NaOH+O2↑.
(4)用A、D单质可以制成一种燃料电池,电池的电解质溶液是稀H2SO4溶液.在电池的多孔电极上分别通入A、D单质,则该电池正极的电极反应式为O2+4 H++4e-=2H2O.
(5)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种单质和一种化合物,生成物对环境都无污染.在火箭推进剂发生燃烧时,1mol C2D4和足量C2A4完全反应生成两种气态产物放出的热量为258.4KJ,则该反应的热化学方程式为2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-258.4 kJ•mol-1.
分析 A、B、C、D、E、F六种短周期元素,原子序数依次增大,B元素原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A元素的原子半径最小,则A为氢元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为氮元素;A、E同主族,则E为钠元素;A、B、C、E五种元素都能与D元素形成原子个数比不相同的常见化合物,则D为氧元素.
解答 解:A、B、C、D、E、F六种短周期元素,原子序数依次增大,B元素原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;A元素的原子半径最小,则A为氢元素;C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,Y为硝酸铵,则C为氮元素;A、E同主族,则E为钠元素;A、B、C、E五种元素都能与D元素形成原子个数比不相同的常见化合物,则D为氧元素.
(1)B为碳元素,在周期表中的位置是:第二周期IVA族,C元素单质为N2,结构式为N≡N,
故答案为:第二周期IVA族;N≡N;
(1)含有A、D、E三种元素的化合物为NaOH,电子式是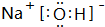 ,
,
故答案为: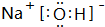 ;
;
(3)E与D形成的一种化合物与H2O发生氧化还原反应,该反应的化学方程式为:2Na2O2+2H20=4NaOH+O2↑,
故答案为:2Na2O2+2H20=4NaOH+O2↑;
(4)用氢气、氧气可以制成一种燃料电池,电池的电解质溶液是稀H2SO4溶液,原电池正极发生还原反应,氧气在正极获得电子,酸性条件下生成水,则该电池正极的电极反应式为:O2+4 H++4e-=2H2O,
故答案为:O2+4 H++4e-=2H2O;
(5)N2H4和N2O4燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染,反应生成氮气与水,反应方程式为:2N2H4+N2O4═3N2+4H2O,已知1mol N2O4和N2H4完全反应生成两种气体时放出热量258.4KJ,则该反应的热化学方程式为2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-258.4 kJ•mol-1,
故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-258.4 kJ•mol-1.
点评 本题考查结构性质位置关系、元素化合物性质、原电池、热化学方程式书写等,是对学生综合能力的考查.

| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
| A. | CH3COOH的浓度比NaOH溶液大,反应后醋酸过量呈酸性 | |
| B. | CH3COOH溶液中水的电离程度大于NaOH溶液中水的电离程度 | |
| C. | 反应后溶液中的离子浓度一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 反应后的溶液中c(Na+)与c(CH3COO-)可能相等 |
| A. | 甲烷 | B. | 苯 | C. | 乙酸丙酯 | D. | 乙二醛(OHC-CHO) |
| A. | 对燃煤及燃煤烟气进行脱硫 | |
| B. | 推广天然气、甲醇等作为汽车的燃料 | |
| C. | 对含SO 2、NO 2的废气处理后再排空 | |
| D. | 人工收集大气雷电产生的氮的氧化物 |
| A. | v (X)正=v (X)逆=0 | |
| B. | v (X):v (Y)=l:2 | |
| C. | 容器内X、Y、Z的浓度不随时间变化 | |
| D. | 单位时间消耗0.1 molX同时生成0.2molZ |
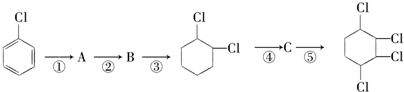
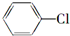 制备
制备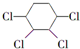
 B:
B: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$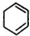 +2NaCl+2H2O
+2NaCl+2H2O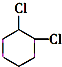 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体: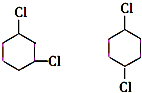

 .
. (填结构简式).
(填结构简式).


