题目内容
10.相同条件下,有机物M的蒸气密度为H2的44倍,且M在酸性条件下可水解得到饱和一元酸和饱和一元醇,若不考虑立体异构,则有机物M的可能结构有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 相同条件下,有机物M的蒸气密度为H2的44倍,故式量为88,酸性条件下可水解得到饱和一元酸和饱和一元醇,故属于酯类物质,分子式为C4H8O2的酯为饱和一元酯,形成酯的羧酸与醇的碳原子总数为4,讨论羧酸与醇含有的碳原子,判断形成该酯的羧酸与醇的同分异构体种数,计算同分异构体数目.
解答 解:相同条件下,有机物M的蒸气密度为H2的44倍,故式量为88,酸性条件下可水解得到饱和一元酸和饱和一元醇,故属于酯类物质,分子式为C4H8O2的酯在酸性条件下可水解为酸和醇,属于饱和一元酯,
可为甲酸和丙酯,甲酸异丙酯,乙酸乙酯,丙酸甲酯,故有机物共有4种.
故选C.
点评 本题考查同分异构体的书写与判断,难度中等,关键是形成酯的羧酸与醇的同分异构体的判断,注意利用数学法进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.元素性质的周期性变化不包括( )
| A. | 原子半径 | B. | 元素的主要化合价 | ||
| C. | 相对原子质量 | D. | 金属性和非金属性 |
2. 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )| A. | CD段二氧化碳气体的体积小于BC段二氧化碳气体的体积 | |
| B. | 在OB、BC、CD三段中,BC段的反应速率最快,原因是该反应放热,温度在BC段起主要作用 | |
| C. | 相同条件下,向上述反应的溶液中加入NaCl溶液可降低化学反应的速率 | |
| D. | OB段反应物浓度大,所以OB段反应速率最快 |
19.下列物质中既含有离子键又含有极性键的是( )
| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
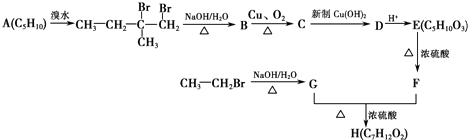
 +2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$
+2Cu(OH)2+OH-$\frac{\underline{\;\;△\;\;}}{\;}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.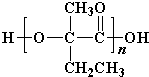 .
.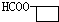 、
、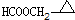 .
. 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
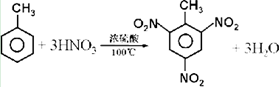
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答: 人们对苯及芳香烃的认识是一个不断深化的过程.
人们对苯及芳香烃的认识是一个不断深化的过程. .
. .
.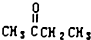 )、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2.
)、丙酮和琥珀酸(HOOC-CH2CH2-COOH)的混合物,该烃的结构简式是CH3CH2C(CH3)=CHCH2CH2CH=C(CH3)2. 制备
制备

 B:
B: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaCl+2H2O
+2NaCl+2H2O 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体: