题目内容
11.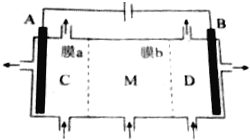 离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )
离子交换膜在电解池和原电池中有着独特的作用.利用离子交换膜技术,通过如图所示装置电解Na2SO3溶液制取NaOH溶液和H2SO4溶液(其中A、B电极为惰性电极).下列说法正确的是( )| A. | a膜为阳离子交换膜 | |
| B. | 溶液中SO${\;}_{3}^{2-}$由M室经b膜移向D室 | |
| C. | A极的电极反应式为SO${\;}_{3}^{2-}$+2e-+H2O═SO${\;}_{4}^{2-}$+2H+ | |
| D. | C室溶液呈酸性,M室溶液呈中性,D室溶液呈碱性 |
分析 电解饱和Na2SO4溶液时,阳极附近是OH-放电,生成氧气,阴极附近时H+放电生成氢气,由于装置中放置了离子交换膜,在两极分别生成NaOH和H2SO4,需在阳极室一侧放置阴离子交换膜,只允许通过阴离子,在阴极一侧放置阳离子交换膜,只允许通过阳离子,接电源正极的是阳极,即B放出氧气,C生成氢气,以此解答该题.
解答 解:A.在阴极一侧放置阳离子交换膜,只允许通过阳离子,接电源负极的是阴极,A为阳极,放阴离子交换膜,故A错误;
B.阴离子向阳极移动,故由M室经a膜移向C室,故B错误;
C.A为阳极,失去电子发生氧化反应,故C错误;
D.A为阳极,亚硫酸根失去电子生成氢离子和硫酸根,使得氢离子浓度增大,故硫酸在阳极生成,C室呈酸性;B为阴极,氢离子得电子生成氢气,使得氢氧根离子浓度增大,NaOH在阴极附近生成,D室呈碱性,M室平衡电荷,溶液呈中性,故D正确.
故选:D.
点评 本题考查电解池知识,为高频考点,本题设置新情景,即离子交换膜,注意根据两极上的反应判断生成物,有利于培养学生的分析能力和良好的科学素养,题目难度中等.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
1.元素性质的周期性变化不包括( )
| A. | 原子半径 | B. | 元素的主要化合价 | ||
| C. | 相对原子质量 | D. | 金属性和非金属性 |
2.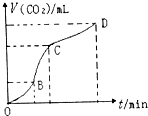 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
 如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )
如图是用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体所绘制的图.请你根据图形判断,下列有关说法错误的是( )| A. | CD段二氧化碳气体的体积小于BC段二氧化碳气体的体积 | |
| B. | 在OB、BC、CD三段中,BC段的反应速率最快,原因是该反应放热,温度在BC段起主要作用 | |
| C. | 相同条件下,向上述反应的溶液中加入NaCl溶液可降低化学反应的速率 | |
| D. | OB段反应物浓度大,所以OB段反应速率最快 |
19.下列物质中既含有离子键又含有极性键的是( )
| A. | KOH | B. | NaCl | C. | O2 | D. | NH3 |
16. 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:
(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
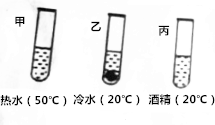
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
由图实验可知影响物质溶解性的因素有温度、溶剂的种类,实验中若将甲试管溶液降温至t1℃时,溶液恰好饱和,则t1℃时,X的溶解度时20g,若往甲中加入5g水,改变温度至t2℃时,溶液又恰好饱和,则t1>t2(填“>”“<”或“=”).
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
 根据溶液有关知识,回答下列问题:
根据溶液有关知识,回答下列问题:(1)生理盐水是质量分数为0.9%的氯化钠溶液,实验室若要配制生理盐水200g,应称取氯化钠固体1.8g,实验中要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管.
(2)在甲、乙、丙三支试管中各放入2gX晶体.再分别加入质量都为10.0g的热水、冷水、酒精,充分搅拌静置后,结果如图所示.
| 温度/℃ | 10 | 30 | 50 | 70 | |
| 溶解度/g | NaCl | 35.8 | 36.3 | 37.0 | 37.8 |
| KNO3 | 20.9 | 45.8 | 85.5 | 138 | |
(3)根据表中提供的信息用结晶的方法分离NaCl和KNO3的混合物,取100g混合物于100g热水中,完全溶解后,冷却至10℃,要得到纯净的KNO3晶体,混合物中KNO3的质量m的取值范围是85.5 g>m>64.2g.
3.有关如图所示化合物的说法正确的是( )
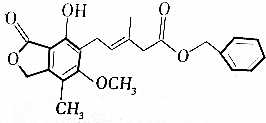

| A. | 该物质的化学式是C23H24O6 | |
| B. | 1mol该化合物最多可以与9molH2加成 | |
| C. | 酸性KMnO4溶液、溴水能与该物质发生氧化还原反应而褪色 | |
| D. | 该物质与FeCl3溶液作用可显红色,该反应可用于检验其中的酚羟基 |
16.等物质的量下列物质中,完全燃烧时消耗O2最少的是( )
| A. | 甲烷 | B. | 苯 | C. | 乙酸丙酯 | D. | 乙二醛(OHC-CHO) |
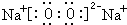 .X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.
.X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是(用化学式表示)H2O2.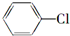 制备
制备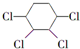
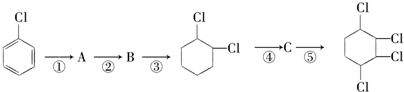
 B:
B: .
. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$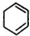 +2NaCl+2H2O
+2NaCl+2H2O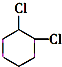 的含有六元碳环的同分异构体:
的含有六元碳环的同分异构体: