题目内容
15.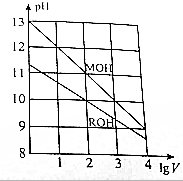 常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )
常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )| A. | MOH是强碱,ROH是弱碱 | |
| B. | 原ROH溶液的浓度为1.0mol/L | |
| C. | 常温下,ROH的电离平衡常数Kb约为1.1×10-5 | |
| D. | 当1gV=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}<10$ |
分析 A.由图可知,MOH的pH=13时稀释100倍,pH变为11,则MOH为强碱,而ROH的pH=10时稀释10倍后pH>9,则说明ROH为弱碱;
B.根据未稀释时MOH的pH=13,可知溶液浓度为0.1mol/L;
C.存在平衡:ROH?R++OH-,稀释100倍后,ROH的pH=10,溶液中c(R+)≈c(OH-)=10-4mol/L,结合Kb=$\frac{c({R}^{+})×c(O{H}^{-})}{c(ROH)}$计算;
D.当1gV=2时,溶液中c(M+)=10-3mol/L,而溶液中c(R+)≈c(OH-)=10-4mol/L,升高温度促进ROH的电离,溶液中c(R+),而c(M+)不变.
解答 解:A.由图可知,MOH的pH=13时稀释100倍,pH变为11,则MOH为强碱,而ROH的pH=10时稀释10倍后pH>9,则说明ROH为弱碱,故A正确;
B.根据未稀释时MOH的pH=13,则MOH溶液浓度为0.1mol/L,二者溶液相等,则原ROH溶液的浓度为0.1mol/L,故B错误;
C.存在平衡:ROH?R++OH-,稀释100倍后,ROH的pH=10,溶液中c(R+)≈c(OH-)=10-4mol/L,则c(ROH)=0.1mol/L÷100-10-4mol/L=9×10-4mol/L,则Kb=$\frac{c({R}^{+})×c(O{H}^{-})}{c(ROH)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{9×1{0}^{-4}}$≈1.1×10-5,故C正确;
D.当1gV=2时,溶液中c(M+)=10-3mol/L,而溶液中c(R+)≈c(OH-)=10-4mol/L,此时溶液中$\frac{c({M}^{+})}{c({R}^{+})}$=$\frac{1{0}^{-3}}{1{0}^{-4}}$=10,升高温度促进ROH的电离,溶液中c(R+),而c(M+)不变,则升高温度后$\frac{c({M}^{+})}{c({R}^{+})}$<10,故D正确.
故选:B.
点评 本题考查弱电解质电离与影响因素、电离平衡常数、pH有关计算等,关键是根据pH的变化判断强弱电解质,注意理解电离平衡常数计算过程中的估算问题,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.1 mol•L-1氨水,溶液的pH>13 | |
| B. | 0.1 mol•L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 | |
| C. | 0.1 mol•L-1醋酸溶液中:c(H+)=c(CH3COO-) | |
| D. | 0.1 mol•L-1醋酸与0.1 mol•L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| A. | 混合溶液呈中性 | |
| B. | a≥b | |
| C. | 混合溶液中,c(A-)=c(Na+) | |
| D. | 混合液中水电离出c(OH-)大于该温度下纯水电离出c(OH-) |
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题. 实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图:
实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图: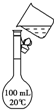 用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸:
用18mol/L的浓硫酸配制150.00mL 1.00mol/L硫酸: ;
; .
. 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:

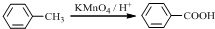
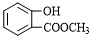 .
.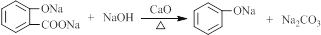 .
.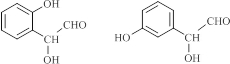 (写结构简式).
(写结构简式).