题目内容
3. 实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图:
实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如图:请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480mL 0.50mol/L的稀硫酸,需取该浓硫酸13.6mL.
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.
(3)要从所配溶液中取出50mL盛装于试剂瓶中,给它贴上标签,则标签的内容是0.50mol/LH2SO4(aq);若再从中取出10mL溶液稀释至20mL,则稀释后溶液的物质的量浓度为0.25mol/L.
(4)下列操作会使所配溶液浓度偏低的是BE.
A.用量筒量取浓硫酸,读数时仰视刻度线
B.转移溶液时未洗涤烧杯
C.容量瓶用蒸馏水洗净后仍残留有蒸馏水
D.定容时俯视容量瓶的刻度线
E.定容摇匀后,发现液面低于刻度线,再加水至刻度线.
分析 (1)配制480mL 0.50mol/L的稀硫酸,实验室没有480mL的容量瓶,应该选用500mL的,根据稀释前后溶质的物质的量不变,据此计算;
(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20mL量筒、烧杯、玻璃棒;
(3)标签上应写明硫酸的浓度,即0.50mol•L-1H2SO4(aq);稀释前后溶质的物质的量不变,10×10-3L×0.5mol•L-1=20×10-3L×c,c=0.25mol•L-1;
(4)A、用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量增加,所配溶液浓度增加,不符合题意;
B、转移时,未洗涤烧杯,溶质的物质的量减少,所配溶液的浓度降低,符合题意;
C、容量瓶残留蒸馏水,对本实验无影响,不符合题意;
D、定容时俯视容量瓶,所配溶液的体积减少,物质的量浓度增加,不符合题意;
E、定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,B、E是符合题意的.
解答 解:(1)配制480mL 0.50mol/L的稀硫酸,实验室没有480mL的容量瓶,应该选用500mL的,稀释前后溶质的物质的量不变,v×$\frac{1000×1.84×98%}{98}$=500×10-3×0.5,v=13.6×10-3L,需要该浓硫酸13.6mL,
故答案为:13.6;
(2)配制该物质的量浓度需要的仪器有500mL的容量瓶、胶头滴管、20mL量筒、烧杯、玻璃棒,
故答案为:500mL容量瓶、胶头滴管;
(3)标签上应写明硫酸的浓度,即0.50mol•L-1H2SO4(aq),稀释前后溶质的物质的量不变,10×10-3L×0.5mol•L-1=20×10-3L×c,c=0.25mol•L-1,
故答案为:0.50mol/L H2SO4(aq),0.25mol/L;
(4)A、用量筒量取浓硫酸,读数时仰视,量取的液体体积增大,溶质的物质的量增加,所配溶液浓度增加,不符合题意;
B、转移时,未洗涤烧杯,溶质的物质的量减少,所配溶液的浓度降低,符合题意;C、容量瓶残留蒸馏水,对本实验无影响,不符合题意;
D、定容时俯视容量瓶,所配溶液的体积减少,物质的量浓度增加,不符合题意;
E、定容时摇匀后,发现液面低于刻度线,再加水至刻度线,对原溶液稀释,物质的量浓度偏低,符合题意,
故答案为:BE.
点评 本题考查溶液浓度的计算和一定物质的量浓度溶液的配制,明确配制原理和步骤是解题关键,注意容量瓶使用方法及误差分析的技巧,题目难度不大.

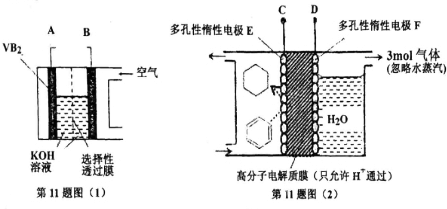
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小 |
| A. | 加少量烧碱固体 | B. | 降低温度 | C. | 加少量冰醋酸 | D. | 加水 |
| A. | 用量筒量取浓盐酸时俯视量筒刻度进行读数 | |
| B. | 定容时俯视容量瓶瓶颈刻度线 | |
| C. | 溶解搅拌时有液体飞溅 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
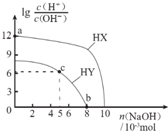 常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.1mol?L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述正确的是( )| A. | HX的酸性弱于HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时酸碱恰好完全反应 |
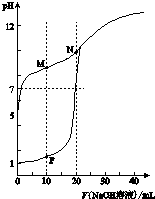 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
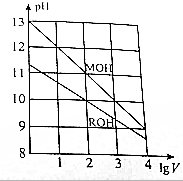 常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )
常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )| A. | MOH是强碱,ROH是弱碱 | |
| B. | 原ROH溶液的浓度为1.0mol/L | |
| C. | 常温下,ROH的电离平衡常数Kb约为1.1×10-5 | |
| D. | 当1gV=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}<10$ |
| A. | 氯化铵热分解反应 | B. | 氮气和氢气化合生成氨的反应 | ||
| C. | 碘升华 | D. | 绿色植物的光合作用生成淀粉 |
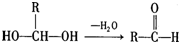 ,请回答下列问题:
,请回答下列问题:
 .
. ;④
;④ .
.