题目内容
14.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流表.此电池 的负极是锌,电极反应式为Zn-2e-=Zn2+;正极的电极反应式为2H++2e-=H2↑.
(2)一切化学反应除了有质量的变化外,还伴随着能量的变化,能量变化通常主要表现为热量的变化,即放热或者吸热.
(3)可逆反应2SO2+O2?2SO3,如果SO2的起始浓度为2mol•L-1,2min后SO2的浓度为1.8mol•L-1,则用SO2的浓度变化表示的反应速率为:0.1mol•L-1•min-1,用O2的浓度变化表示的反应速率为0.05mol•L-1•min-1.
分析 (1)先根据电极材料的活泼性判断正负极,然后根据得失电子顺序写出相应的电极反应式;
(2)一切化学反应除了有质量的变化外,还伴随着能量的变化,能量变化通常主要表现为热量的变化,即放热或者吸热;
(3)根据v=$\frac{△c}{t}$进行计算.
解答 解:(1)根据电极材料的活泼性知,锌作负极,银作正极,负极上锌失电子变成离子进入溶液;正极上,溶液中的氢离子得电子生成氢气,
故答案为:锌;Zn-2e-=Zn2+;2H++2e-=H2↑;
(2)一切化学反应除了有质量的变化外,还伴随着能量的变化,能量变化通常主要表现为热量的变化,即放热或者吸热,故答案为:能量;热量;放热;吸热;
(3)△c(SO2)=2mol•L-1-1.8mol•L-1=0.2mol•L-1,v(SO2)=$\frac{0.2mol•{L}^{-1}}{2min}$=0.1 mol•L-1•min-1,根据速率与化学计量数成正比,v(O2)=$\frac{1}{2}$×$\frac{0.2mol•{L}^{-1}}{2min}$=0.05 mol•L-1•min-1,
故答案为:0.1 mol•L-1•min-1;0.05 mol•L-1•min-1.
点评 本题考查了原电池原理的分析判断,电极反应,电极名称、化学反应速率的计算,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
3.下列有关NaAl(SO4)3溶液的叙述正确的是( )
| A. | 该溶液中NH4+、S2-、Fe3+、K+可以大量共存 | |
| B. | 与NaHCO3溶液的反应为Al3++3HCO3-═Al(OH)3↓+3CO2↑ | |
| C. | 通入过量的氨气,最终看不到沉淀 | |
| D. | 与Ba(OH)2反应使SO42-沉淀完全的离子方程式为2Al3++6OH-+3SO42-+3Ba2+═2Al(OH)3↓+3BaSO4↓ |
3.下列叙述正确的是( )
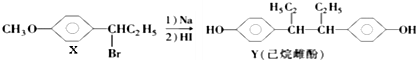
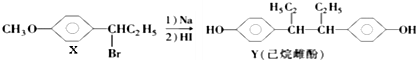
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件下,化合物Y可与Br2发生加成反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y中不含有手性碳原子 |
4.下列说法正确的是( )
| A. | 该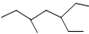 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. | 该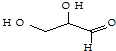 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol |
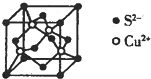 硫及其化合物具有广泛的用途.回答下列问题:
硫及其化合物具有广泛的用途.回答下列问题: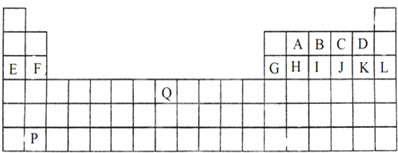
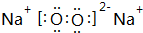 .
.