题目内容
19.下列各题中有关物质的比较,请用“>”、“<”、“=”填空:(1)酸性:H3PO4<HNO3,H2SO4<HClO4;
(2)氧化性:Cl2>S,N2<O2;
(3)碱性:KOH> NaOH,Mg(OH)2> Al(OH)3.
分析 (1)从元素最高价氧化物对应水合物的酸碱性强弱规律思考;
(2)同周期元素从左到右元素单质氧化性逐渐增强;
(3)从元素单质氧化性强弱规律和简单离子还原性规律分析.
解答 解:(1)根据同主族元素从上到下元素最高价氧化物对应水合物的酸性逐渐减弱,可知:酸性H3PO4<HNO3;同一周期,原子序数越大,非金属性越强,可知:酸性:H2SO4<HClO4;故答案为:<;<;
(2)根据同周期元素从左到右元素单质氧化性逐渐增强,可知:氧化性Cl2>S;同一周期,原子序数越大,非金属性越强,故非金属性:N2<O2,
故答案为:>;<;
(3)同一主族,金属性随着原子序数递增,逐渐增强,故碱性KOH>NaOH,同一周期,金属性随着原子序数递增,金属性逐渐减弱,故碱性:Mg(OH)2>Al(OH)3,故答案为:>;>.
点评 本题考查了元素周期律的理解与应用,注意把握元素周期律的递变规律以及相关知识的积累,难度不大.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
8.下列事实能说明氯气与水的反应是可逆反应的是( )
| A. | 氯水的漂白作用 | B. | 氯水呈黄绿色 | ||
| C. | 氯水与NaOH反应 | D. | 氯水与锌反应产生H2 |
9.对于反应CO(g)+H2O(g)?H2(g)+CO2(g)正反应是放热反应,在其他条件不变的情况下,下列说法正确的是( )
| A. | 加入催化剂,改变了反应的途径,反应放出的热量也一定发生变化 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
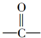 与HCN反应引入:
与HCN反应引入: $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$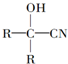
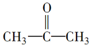 $→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D
$→_{一定条件①}^{HCN}$A$\underset{\stackrel{{H}_{2}O,{H}^{+}}{→}}{②}$B$→_{③}^{浓H_{2}SO_{4},△}$C$→_{催化剂④}^{聚合}$D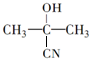 ,D
,D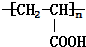 .
.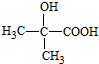 $→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.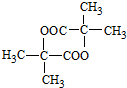 .
.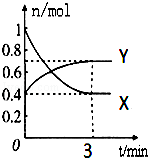 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示. 或
或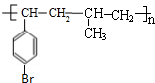 .
.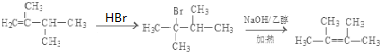 .
.