题目内容
4.下列说法正确的是( )| A. | 该 有机物的系统命名为:3-乙基-5-甲基庚烷 有机物的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 等质量的某烷烃a和某烯烃b,两者完全烧烧后产生的CO2的量有可能a>b | |
| C. | 该 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 | |
| D. | 1mol该 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol 有机物在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH 10mol |
分析 A.有机物主链含有7个C原子,有2个侧链,分别为甲基和乙基;
B.烷烃的含碳量小于烯烃;
C.含有羟基和醛基,羟基可发生取代、消去反应,醛基可发生加成、氧化和还原反应;
D.能与氢氧化钠反应的为酯基、酚羟基、Br原子,且可水解生成酚羟基、HBr和碳酸等.
解答 解:A.有机物主链含有7个C原子,有2个侧链,分别为甲基和乙基,主链从左端编号,名称为3-甲基-5-乙基庚烷,故A错误;
B.烷烃的含碳量小于烯烃,则等质量时烯烃生成的二氧化碳质量偏大,故B错误;
C.含有羟基和醛基,羟基可发生取代、消去反应,醛基可发生加成、氧化和还原反应,故C正确;
D.有机物含有2个酯基、2个Br原子,1个酚羟基和一个肽键,与氢氧化钠反应的为酯基、酚羟基、Br原子,且可水解生成酚羟基、HBr和碳酸等,则1mol该有机物 在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH9mol,故D错误.
在一定条件下与足量NaOH溶液完全反应,最多可消耗NaOH9mol,故D错误.
故选C.
点评 本题综合考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,题目涉及有机物的名称以及有机物组成的判断,注意把握有机物官能团的种类和性质,难度中等.

练习册系列答案
相关题目
15.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
12.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:④Mg;⑫Br.
(2)画出原子的结构示意图:⑤ ;⑪
;⑪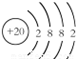 .
.
(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
(7)元素①是动植物生长不可缺少的元素,是蛋白质的重要成分.其氢化物常用作制冷剂,该氢化物的电子式为: ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
 ;⑪
;⑪ .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
(7)元素①是动植物生长不可缺少的元素,是蛋白质的重要成分.其氢化物常用作制冷剂,该氢化物的电子式为:
 ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
19.下列热化学方程式中的△H能表示可燃物的燃烧热的是( )
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O(1)△H=-571.6 kJ/mol |
9.对于反应CO(g)+H2O(g)?H2(g)+CO2(g)正反应是放热反应,在其他条件不变的情况下,下列说法正确的是( )
| A. | 加入催化剂,改变了反应的途径,反应放出的热量也一定发生变化 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
16.下列说法中,与盐的水解无关的正确说法是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
| A. | ①④⑥ | B. | ②③⑤ | C. | ③④⑤ | D. | 全有关 |
13.最容易形成阳离子的元素是( )
| A. | K | B. | Na | C. | F | D. | Cl |