题目内容
5. 硫及其化合物具有广泛的用途.回答下列问题:
硫及其化合物具有广泛的用途.回答下列问题:(l)Se与S同主族,且为相邻周期,基态Se原子核外电子排布式为1s22s22p63s23p63d104s22p4
若ls22s22p63s13p5是S原子的核外电子排布式,出现这种排布现象的原因是S原子3s轨道的1个电子激发到3p轨道.
(2)过渡金属的硫酸盐中形成的配合物较多.如Co(NH3)5ClSO4就是一种配合物,Co化合价为+3,其中含有的化学键类型有离子键、共价键、配位键,在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,则该配合物中配位原子是N、Cl
(3)含硫的有机物具有广泛的用途.如硫代乙酰胺(CH3CSNH2)可用于生产催化剂、农药等,其中两个碳原子的杂化轨道类型分别为sp3、sp2,1mol硫代乙酰胺含有8molσ键,1 molπ键.
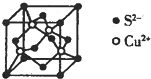
(4)硫化铜纳米晶体在光热疗领域引起广泛关注.图是CuS的晶胞结构,该晶胞的棱长为apm,则CuS的密度为$\frac{384}{{N}_{A}×{a}^{3}×1{0}^{-30}}$g•cm-3(NA表示阿伏加德罗常数的值,用代数式表示,下同),最近的Cu2+与S2-间的距离为$\frac{\sqrt{3}}{4}$apm.
分析 (1)Se原子核外电子数为34,根据能量最低原理书写核外电子排布式;S原子3s轨道的1个电子激发到3p轨道;
(2)根据化合价代数和为0计算Co的化合价;配离子与外界离子之间形成配位键,钴离子与氨气分子等之间形成配位键,氨气分子中、硫酸根离子中含有共价键;在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,说明硫酸根离子为外界,氯离子为配体,配体原子含有孤对电子;
(3)硫代乙酰胺(CH3CSNH2)的结构简式为 ,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3;
,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3;
(4)根据均摊法计算晶胞中Cu、S原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶体密度;Cu2+与周围的4个S2-形成正四面体结构,之间的距离最近,Cu2+与晶胞顶点的S2-连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍.
解答 解:(1)Se原子核外电子数为34,核外电子排布式为1s22s22p63s23p63d104s22p4;若ls22s22p63s13p5是S原子的核外电子排布式,出现这种排布现象的原因是:S原子3s轨道的1个电子激发到3p轨道,
故答案为:1s22s22p63s23p63d104s22p4;S原子3s轨道的1个电子激发到3p轨道;
(2)Cl为-价,硫酸根为-2价,氨气分子为0价,故Co的化合价为+3价;配离子与外界离子之间形成配位键,钴离子与氨气分子等之间形成配位键,氨气分子中、硫酸根离子中含有共价键;在该配合物水溶液中,滴加BaCl2溶液,有白色沉淀,而另取配合物溶液滴加硝酸酸化的AgNO3溶液,则无沉淀生成,说明硫酸根离子为外界,氯离子为配体,N原子、氯原子含有孤对电子,则该配合物中配位原子是N、Cl,
故答案为:+3;离子键、共价键、配位键;N、Cl;
(3)硫代乙酰胺(CH3CSNH2)的结构简式为 ,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3,分别采取sp3、sp2杂化,1mol硫代乙酰胺含有8molσ键,1molπ键,
,甲基中C原子形成4个σ键、另外C原子形成3个σ键,均没有孤对电子,杂化轨道数目分别为4、3,分别采取sp3、sp2杂化,1mol硫代乙酰胺含有8molσ键,1molπ键,
故答案为:sp3、sp2;8;1;
(4)晶胞中Cu原子数目为4,Cu、S原子数目之比为1:1,故S原子数目为4,则晶胞质量为4×$\frac{96}{{N}_{A}}$g,则晶体密度=4×$\frac{96}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{384}{{N}_{A}×{a}^{3}×1{0}^{-30}}$g•cm-3,
Cu2+与周围的4个S2-形成正四面体结构,之间的距离最近,Cu2+与晶胞顶点的S2-连线处于晶胞体对角线上,且距离为体对角线长度的$\frac{1}{4}$,而体对角线长度为晶胞棱长的$\sqrt{3}$倍,则最近的Cu2+与S2-间的距离为 $\frac{\sqrt{3}}{4}$a pm,
故答案为:$\frac{384}{{N}_{A}×{a}^{3}×1{0}^{-30}}$;$\frac{\sqrt{3}}{4}$a.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、配合物、杂化方式、化学键、晶胞计算等,(4)中距离的计算为易错点、难点,需要学生具备一定的数学计算能力.

| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |
| A. | 单质沸点高低顺序为:W<X<Y<Z | |
| B. | 原子半径大小顺序为:W<X<Y<Z | |
| C. | 元素的非金属性强弱顺序为:W<X<Y<Z | |
| D. | 四种元素可以共存于一种离子化合物中 |
| A. | 溶液呈中性,可选用甲基橙或酚酞作指示剂 | |
| B. | 溶液呈中性,只能选用石蕊作指示剂 | |
| C. | 溶液呈碱性,可选用甲基橙或酚酞作指示剂 | |
| D. | 溶液呈碱性,只能选用酚酞作指示剂 |
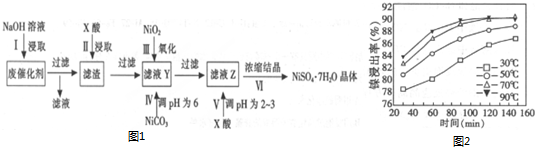
部分阳离子以氢氧物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)第1步加入NaOH溶液的目的是除去Al、Al2O3和油脂等杂质.
(2)“酸浸”时所加入的X酸是硫酸(填化学式).保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图2,“酸浸”的适宜温度与时间分别是C(填选项字母).
A.30℃、30min B.90℃、150min C.70℃、120min
(3)第V步调pH为2~3的目的是(请结合化学用语和平衡移动原理解释)溶液中存在水解平衡Ni2++2H2O?Ni(OH)2+2H+,增大氢离子浓度平衡逆向进行避免浓缩过程中水解生成沉淀.
(4)工业上以铝和NiOOH为电极,NaOH溶液为电解液制成电池.放电时,NiOOH转化为Ni(OH)2,该电池正极反应式是NiO(OH)+H2O+e-═Ni(OH)2+OH-.
(5)已知:2Mg(s)+O2(g)=2Mg(s)△H1=-2075kJ/mol
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H2=+84.6kJ/mol
MgH2(s)+$\frac{1}{2}$O2(g)=MgO(s)+H2(g)△H3=-963kJ/mol
含镍储氢材料(Mg2NiH4)释放氢气和Mg2Ni的热化学方程式是Mg2NiH4(s)=Mg2Ni(s)+2H2(g)△H=+64.4KJ/mol.
(6)在含镍废催化剂中,Ni、Al和Fe的质量分数分别是29.5%、31%和5.6%.a kg含镍废催化剂按上述流程转化,第Ⅱ步加入cmol/L的X酸bL,酸浸后的滤液Y不含Fe3+,滤液Z中残留的酸忽略不计,则第Ⅳ步应加入NiCO30.119(cb-5.5a)kg.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar.
(3)在这些元素中,原子半径最小的是F,原子半径最大的是K.
(4)在这些元素的最高价氧化物对应水化物中,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |