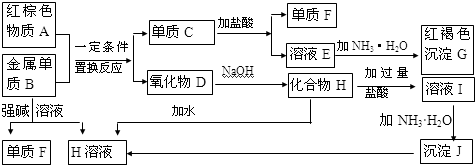
题目内容
20.若用NA表示阿伏加德罗常数的值,则下列说法错误的是( )| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
分析 A、18O2和NO的摩尔质量之比为18:15;
B、气体体积V=nVm;
C、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
D、求出水的物质的量,然后根据水为10电子微粒来分析.
解答 解:A、18O2和NO的摩尔质量之比为18:15,故NA个18O2和NA个NO的质量比为18:15,故A错误;
B、气体体积V=nVm=1mol×22.4L/mol=22.4L,故B正确;
C、24g镁的物质的量为1mol,而镁反应后变为+2价,故1mol镁失去2NA个电子,故C正确;
D、18g水的物质的量为1mol,而水为10电子微粒,故1mol水中含10NA个电子,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
11.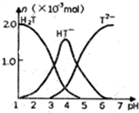 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
8.下列关于pH相同的盐酸和醋酸的说法正确的是( )
| A. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| B. | 醋酸溶液的浓度小于盐酸 | |
| C. | 两种溶液中由水电离出来的c(H+)不相同 | |
| D. | 分别用蒸馏水稀释相同倍数后,盐酸的pH大于醋酸的pH |
15.下列电离方程式中,不正确的是( )
| A. | HCl═H++Cl- | B. | NH3•H2O═NH4++OH- | ||
| C. | CaCl2=Ca2++2Cl- | D. | CH3COOH?CH3COO-+H+ |
5.下列离子方程式正确的是( )
| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+H2O | |
| B. | 石灰水与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 钠与水反应:Na+2H2O═2OH-+Na++H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O |
10.下列离子方程式正确的是( )
| A. | 少量金属钠加到冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |