题目内容
9.下图是中学化学中常见物质的转化关系,部分物质和反应条件略去.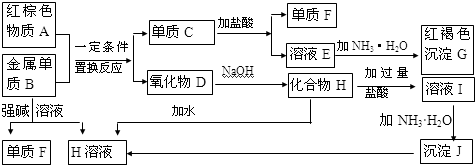
(1)单质F的化学式是H2,写出物质A的一种用途用作油漆颜料,炼铁等.
(2)写出单质B与强碱溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,
写出由沉淀J生成 H溶液的离子方程式Al(OH)3+OH-=AlO2-+2H2O,
(3)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式:Fe2++2OH-=Fe(OH)2↓,白色沉淀L最终变为红褐色沉淀G,写出L变为G的化学反应方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)溶液I中所含金属离子是Na+、Al3+.
分析 金属B与强碱反应得到单质F与H,则B为Al、F为H2,H为偏铝酸盐,G为红褐色沉淀,则G为Fe(OH)3,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为Fe2O3、C为Fe、D为Al2O3,由转化关系可知,E为FeCl2,H为NaAlO2,溶液I为NaCl、HCl、AlCl3混合物,J为Al(OH)3,据此解答.
解答 解:金属B与强碱反应得到单质F与H,则B为Al、F为H2,H为偏铝酸盐,G为红褐色沉淀,则G为Fe(OH)3,红棕色物质A与金属Al发生置换反应生成单质C与氧化物D,则A为Fe2O3、C为Fe、D为Al2O3,由转化关系可知,E为FeCl2,H为NaAlO2,溶液I为NaCl、HCl、AlCl3混合物,J为Al(OH)3.
(1)由上述分析可知,单质F的化学式是H2,物质A为Fe2O3,可以用作油漆颜料,炼铁等,
故答案为:H2;用作油漆颜料,炼铁等;
(2)单质Al与强碱溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,由沉淀J生成 H溶液的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al(OH)3+OH-=AlO2-+2H2O;
(3)溶液FeCl2中加入氨水时,先生成白色沉淀L为Fe(OH)2,离子方程式:Fe2++2OH-=Fe(OH)2↓,白色沉淀会迅速变为灰绿色,最终变为红褐色沉淀,L变为G的化学反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)溶液I为NaCl、HCl、AlCl3混合物,所含金属离子是Na+、Al3+,故答案为:Na+、Al3+.
点评 本题考查无机物推断,物质的颜色及转化关系中特殊反应是推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物知识,难度中等.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.
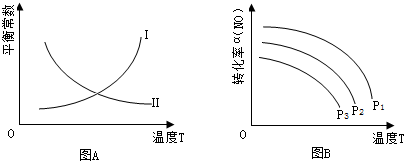
(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
| A. | 放热反应都不需要加热 | |
| B. | 化学反应的热效应数值与参加反应的物质多少有关 | |
| C. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| D. | 焓变是指1 mol物质参加反应时的能量变化 |
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.