题目内容
11.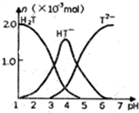 常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )
常温下,向10ml0.2mol•L-1草酸(用H2T表示)溶液中逐滴加入等浓度的NaOH溶液.有关微粒的物质的量与混合溶液的PH有如图关系,下列说法正确的是( )| A. | HT-在溶液中水解程度大于电离程度 | |
| B. | 当V(NaOH)=10mL时,溶液中水的电离程度比纯水大 | |
| C. | 当V(NaOH)=15mL时,溶液中存在:c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+) | |
| D. | 当V(NaOH)=20mL时,溶液中存在:c(OH-)=c(HT-)+2c(H2T)+c(H+) |
分析 A.根据图示信息得到HT-在溶液中存在时的pH进行分析;
B.加入10mLNaOH溶液,反应生成NaHT,溶液呈酸性,抑制了水的电离;
C.当V(NaOH)=15mL时,溶质为等浓度的Na2T和NaHT,溶液还呈酸性,c(H+)>c(OH-);
D.当V(NaOH)=20mL时,恰好反应生成的溶质为Na2T,依据质子守恒来回答.
解答 解:A.根据图示信息得到HT-在溶液中存在时的pH<7,所以HT-在溶液中水解程度小于电离程度,故A错误;
B.VNaOH=10mL时,反应后溶质为NaHT,HT-在溶液中水解程度小于电离程度,溶液呈酸性,抑制了水的电离,则溶液中水的电离程度比纯水小,故B错误;
C.当V(NaOH)=15mL时,溶质为等浓度的Na2T和NaHT,溶液呈酸性,则c(H+)>c(OH-)、c(T2-)>c(HT-),溶液中离子浓度大小为:c(Na+)>c(T2-)>c(HT-)>c(H+)>c(OH-),故C错误;
D、VNaOH=20mL时,与氢氧化钠溶液恰好反应,溶液中溶质为Na2T,图象分析可知溶液呈碱性,依据质子守恒可知:c(OH-)=c(HT-)+2c(H2T)+c(H+),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高考常见题型,题目难度中等,试题侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可.

练习册系列答案
相关题目
17.有下列三个反应方程式:①Cl2+FeI2═FeCl2+I2 ②2Fe2++Br2═2Fe3++2Br-③Co2O3+6HCl═2CoCl2+Cl2↑+3H2O,下列说法正确的是( )
| A. | ①②③中氧化产物分别是FeCl2、Fe3+、Cl2 | |
| B. | 根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ | |
| C. | 在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 | |
| D. | 根据反应①②一定可以推理得到Cl2+FeBr2═FeCl2+Br2 |
2.草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂.草酸的盐可用作碱土金属离子的广谱沉淀剂.
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
(4)结晶水合草酸(H2C2O4•2H2O)成品的纯度用高锰酸钾法测定.称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为:5H2C2O4+2MnO4-+6H+═2Mn2++8H2O+10CO2↑;列式计算该成品的纯度94.5%.
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
16.对于反应:3BrF3+5H2O=Br2+HBrO3+O2+9HF,下列说法正确的是( )
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
3.X、Y、Z三种金属及其化合物间可发生如下反应:
Y+ZCl2═Z+YCl2 X+ZCl2═Z+XCl2
Y+2HCl═YCl2+H2↑ X+HCl→不反应
则X、Y、Z三种金属活动性由强至弱的顺序是( )
Y+ZCl2═Z+YCl2 X+ZCl2═Z+XCl2
Y+2HCl═YCl2+H2↑ X+HCl→不反应
则X、Y、Z三种金属活动性由强至弱的顺序是( )
| A. | Z>X>Y | B. | X>Y>Z | C. | Y>X>Z | D. | Y>Z>X |
20.若用NA表示阿伏加德罗常数的值,则下列说法错误的是( )
| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |