题目内容
5.下列离子方程式正确的是( )| A. | 氢氧化钠溶液中通入足量二氧化硫:SO2+2OH-═SO32-+H2O | |
| B. | 石灰水与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 钠与水反应:Na+2H2O═2OH-+Na++H2↑ | |
| D. | 向少量碳酸氢钠溶液中滴加足量澄清石灰水:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O |
分析 A.二氧化硫足量反应生成亚硫酸氢钠;
B.醋酸为弱酸应保留化学式;
C.电荷不守恒;
D.碳酸氢钠少量,反应生成碳酸钙、氢氧化钠和水.
解答 解:A.氢氧化钠溶液中通入足量二氧化硫,离子方程式:SO2+OH-═HSO3-,故A错误;
B.石灰水与醋酸反应,离子方程式:CaCO3+2CH3COOH═Ca2++CO2↑+H2O+2CH3COO-,故B错误;
C.钠与水反应,离子方程式:2Na+2H2O═2OH-+2Na++H2↑,故C错误;
D.向少量碳酸氢钠溶液中滴加足量澄清石灰水,离子方程式:HCO${\;}_{3}^{-}$+Ca2++OH-═CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.对于反应:3BrF3+5H2O=Br2+HBrO3+O2+9HF,下列说法正确的是( )
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
13.下列变化中,需加还原剂才能实现的是( )
| A. | CuSO4→Cu | B. | Mg→Mg3N2 | C. | S→SO2 | D. | SiO2→Na2SiO3 |
20.若用NA表示阿伏加德罗常数的值,则下列说法错误的是( )
| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
10.将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)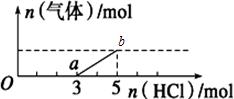
下列说法不正确是( )

下列说法不正确是( )
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
17.醋酸在日常生活和生产中的应用很广泛.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
①写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3;
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
14.常温下,某酸HA的电离常数:K=1×10-5,下列说法正确的是( )
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
15. 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
 在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )
在体积为1L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CO2和CH3OH的浓度随时间变化如图所示.下列说法正确的是( )| A. | 该化学反应在3min时达到平衡状态 | |
| B. | 保持其他条件不变,降低温度,平衡时c(CH3OH)=0.85 mol•L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向上述容器中充入0.5molCO2、1.5molH2,平衡时CO2的转化率小于75% | |
| D. | 12min时,向上述容器中再充入0.25molCO2、0.25molH2O(g),此时反应将向逆反应方向进行 |
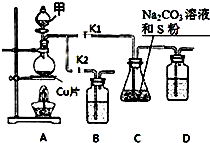 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.