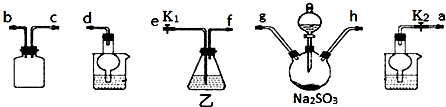题目内容
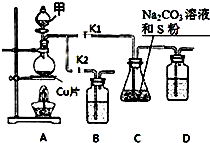
10.摩尔盐[(NH4)2Fe(SO4)2•6H2O]是一种复盐,其制备步骤如下:Ⅰ.铁屑除油:取mg铁屑置于烧杯中,加入15mL 10%的Na2C03溶液,小火加热,用倾析法分离并洗涤铁屑.
Ⅱ.硫酸亚铁制备:向盛铁屑的烧杯中加入15mL 3mol/L的硫酸,水浴加热,趁热过滤.
Ⅲ.硫酸亚铁铵制备:根据反应铁屑的质量算出生成硫酸亚铁的量,加入含等物质的量硫酸铵的饱和溶液,再进行一定的操作,即可得到摩尔盐晶体.
请回答:
(1)步骤I中Na2C03溶液的作用是除去铁屑表面的油污.下列情况适合倾析法的有cd.
a.沉淀呈胶状 b.沉淀呈絮状 c.沉淀容易沉降 d.沉淀颗粒较大
(2)步骤II中铁屑过量的目的是填Fe+2Fe3+=3Fe2+(用离子方程式表示).
(3)步骤IIl中加入硫酸铵溶液后,要得到摩尔盐晶体,需要经过的操作有:加热蒸发、冷却结晶、过滤,用无水乙醇洗涤得到摩尔盐.
(4)为检验晶体中的Fe2+,某同学发现滴入KSCN溶液后,溶液有浅红色出现,于是他对自己的实验方法产生了怀疑.经过思考后,该同学仍使用此方法依(滴入氯水)溶液红色加深现象可以证明有Fe2+存在.
(5)为了测定摩尔盐中Fe2+的含量,称取4.0g摩尔盐样品,溶于水配成溶液并加入稀硫酸,用0.2mol/L的KMn04溶液进行滴定,到滴定终点时,消耗了KMn04溶液10.00mL.
则样品中Fe2+的质量分数为14%.若滴定过程中,摇瓶过于剧烈,则对测定结果的影响是偏低(填“偏高”或“偏低”).
分析 (1)Na2CO3溶液呈碱性,除去铁屑表面的油污;沉淀容易沉降、沉淀颗粒较大适合倾析法;
(2)防止Fe2+被氧化为Fe3+;
(3)步骤Ⅲ中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
(4)铁离子与KSCN反应络合反应得到血红色物质,铁离子浓度越大,溶液红色越深;
(5)根据关系式5Fe2+~MnO4-计算4g产品中Fe2+的物质的量,再根据m=nM计算Fe2+的质量,利用质量分数定义计算;
摇瓶过于剧烈,会导致溶液溅出,消耗标准液的体积偏小.
解答 解:(1)Na2CO3溶液中CO32-水解CO32-+H2O
故答案为:除去铁屑表面的油污;cd;
(2)Fe2+易被氧化为Fe3+,氧化的Fe3+与Fe发生反应Fe+2Fe3+=3Fe2+,防止Fe2+被氧化为Fe3+,
故答案为:Fe+2Fe3+=3Fe2+;
(3)步骤3中,加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体,
故答案为:冷却结晶;过滤;
(4)铁离子与KSCN反应络合反应得到血红色物质,铁离子浓度越大,溶液红色越深,再向溶液中滴加氯水,若溶液颜色加深,证明含有溶液含有亚铁离子,
故答案为:(滴入氯水)溶液红色加深;
(5)反应中Fe2+→Fe3+,MnO4-+→Mn2+,令4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-
5 1
xmol 0.01L×0.2mol/L
所以x=$\frac{0.01L×\;0.2mo1/L\;×5}{1}$=0.01mol
所以4g产品中Fe2+的质量0.01mol×56g/mol=0.56g,
所以4g产品中Fe2+的质量分数为$\frac{0.56g}{4g}$×100%=14%,
摇瓶过于剧烈,会导致溶液溅出,消耗标准液的体积偏小,测定结果偏低,
故答案为:14%;偏低.
点评 本题以莫尔盐的制备为载体,考察盐类水解、氧化还原反应、氧化还原反应滴定应用、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力,题目有一定的难度,注意基础知识的全面掌握.

| A. | [Cl-]>[NH4+]>[H+]>[OH-] | B. | [NH4+]>[Cl-]>[OH-]>[H+] | C. | [Cl-]>[NH4+]>[OH-]=[H+] | D. | [Cl-]=[NH4+]>[H+]>[OH-] |
| A. | ①②③中氧化产物分别是FeCl2、Fe3+、Cl2 | |
| B. | 根据以上反应的化学方程式可以得到氧化性强弱关系为Cl2>Co2O3>Fe3+ | |
| C. | 在反应③中生成1 mol Cl2时,有2 mol HCl被氧化 | |
| D. | 根据反应①②一定可以推理得到Cl2+FeBr2═FeCl2+Br2 |
| A. | 0.1mol•L-1的FeCl3溶液中:HCO3-、K+、SO42-、Br- | |
| B. | 滴入酚酞试液显红色的溶液中:NH4+、SO42-、Fe2+、Cl- | |
| C. | 通入大量SO2的溶液中:Na+、Cl-、S2-、SO42- | |
| D. | pH=1的溶液中:Mg2+、Ca2+、NO3-、Ag+ |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 0~2 min的平均速率v(Z)=2.0×10-3 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡时v(正)>v(逆) | |
| C. | 该温度下此反应的平衡常数K=144 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
(1)草酸的电离方程式:H2C2O4?HC2O4-+H+ HC2O4-?C2O42-+H+.
(2)浓度为0.1mol/L的Na2C2O4溶液中:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1mol/L
(3)40℃时混合一定体积的0.1mol/L H2C2O4溶液与一定体积0.01mol/L酸性KMnO4溶液,填写表中空格.
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
(5)常温下MgC2O4的Ksp=8.1×10-5,已知当溶液中某离子的浓度≤10-5mol/L时可认为该离子已沉淀完全.现为了沉淀1L0.01mol/LMgCl2溶液中的Mg2+,加入100mL0.1mol/L的(NH4)2C2O4溶液,通过计算判断Mg2+是否已沉淀完全(写出计算过程).
| A. | NA个18O2和NA个NO的质量比为16:15 | |
| B. | 标准状况下1molCO和CO2的混合物的体积约占22.4L | |
| C. | 24gMg在足量空气中完全燃烧失去2NA个电子 | |
| D. | 常温下,18gH2O含有的电子数为10NA |
 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.