题目内容
5.肼(H2N-NH2)是一种高能燃料,有关化学反应的为N2H4(g)+O2═N2(g)+2H2O(g)△H=-576KJ/mol,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,H-O为463则断裂1molN-H键所需的能量(kJ)是( )| A. | 391 | B. | 194 | C. | 516 | D. | 658 |
分析 反应中焓变等于反应物中键能之和-生成物中键能之和,以此来解答.
解答 解:设断裂1molN-H键所需的能量为x,
由反应及焓变等于反应物中键能之和-生成物中键能之和可知,
4x+154+500-942-2×2×463=-576,
解得x=391(kJ),
故选A.
点评 本题考查反应热与焓变,为高频考点,把握焓变与物质的键能关系为解答的关键,侧重分析与计算能力的考查,注意判断物质中的化学键,题目难度不大.

练习册系列答案
相关题目
15.下列关于化学反应速率的说法正确的是( )
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
16.下列说法或表示方法正确的是( )
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)═C(金刚石)△H=1.9 kJ•mol”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ |
13.已知乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如表所示:
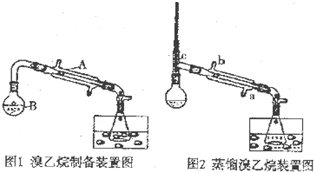
某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约为140mL)置于图1的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是直形冷凝管
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2,为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取,填选项字母)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠溶液 c.无水CaCl2 d.浓硫酸
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的c(从上面的a--d中选取,填选项字母),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若试验中使用的无水乙醇的体积是46mL,蒸馏后得到纯溴乙烷的体积是50mL,则溴乙烷的产率为80%.
| 溶解性 | 沸点 | 密度(g/mL) | |
| 乙醇 | 与水互溶 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水 | 38.4 | 1.4 |

某研究性学习小组的同学将乙醇、80%的硫酸、NaBr固体按一定比例混合后(总体积约为140mL)置于图1的反应容器B中后进行加热(两个装置中的加热、固定装置及沸石均省略).
(1)①仪器A的名称是直形冷凝管
(2)两个水槽中的液体均是冰水,使用冰水的目的是降温,减少溴乙烷的挥发.
(3)HBr与乙醇反应生成目标产物的化学方程式HBr+CH3CH2OH$\stackrel{△}{→}$CH3CH2Br+H2O.
(4)图1中收集到的产品中含有一定量的杂质Br2,为除去该杂质,可先向混合液中加入适量的(从下面所给试剂中选取,填选项字母)b,然后再进行分液操作即可.
a.四氯化碳 b.碳酸钠溶液 c.无水CaCl2 d.浓硫酸
(5)经过(4)处理后的目标产物中还含有少量的水等杂质,可通过向产品中加入一定量的c(从上面的a--d中选取,填选项字母),充分作用后,过滤,将滤液使用图2中的装置进行提纯,冷却水应从a口(填a或b)进入.
(6)若试验中使用的无水乙醇的体积是46mL,蒸馏后得到纯溴乙烷的体积是50mL,则溴乙烷的产率为80%.
20.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)═SiO2(s)△H=-989.2kJ•mol-1,则表中X的值为( )
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
10.在一定温度下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
2molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
2molCO和2mol CH4组成的混合气体,在相同条件下完全燃烧时,释放的热量为( )
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
14.某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| A. | 充电时,阳极附近 pH 值减小 | |
| B. | 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O | |
| C. | 放电时,负极上发生反应的物质是Fe(OH)2 | |
| D. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).