题目内容
15.下列关于化学反应速率的说法正确的是( )| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
分析 化学反应速率为单位时间内浓度的变化,是定量描述化学反应快慢的物理量,反应速率的快慢不一定与现象有关,以此解答该题.
解答 解:A.反应速率快的现象不一定明显,如NaOH与HCl的反应,反应速率慢的现象可能明显,如铁生锈,故A错误;
B.化学反应速率为“0.8mol/(L•s)”表示的意思是:一段时间内,某物质的平均速率为0.8mol/(L•s),故B错误;
C.化学反应为动态平衡,达到平衡时,反应没有停止,故C错误;
D.化学反应速率为单位时间内浓度的变化,是定量描述化学反应快慢的物理量,故D正确.
故选D.
点评 本题考查化学反应速率的概念及影响因素、为高频考点,侧重于学生的分析能力的考查,注意反应速率与反应现象的关系,难度不大.要注意化学反应速率是平均速率,不是瞬时速率.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
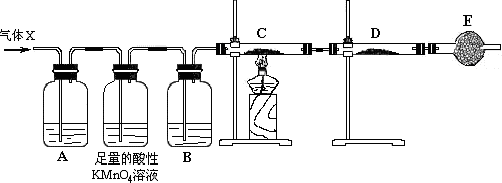
5.已知浓硫酸和木炭粉在加热条件下可发生化学反应.
(1)上述反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置中导管口的编号):
g接c(或d),d(或c)接a,b接f.
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色.B瓶中的溶液的作用是除去SO2气体,避免对CO2的检验产生干扰;
(4)装置②中所加固体药品是无水硫酸铜,装置③中所加试剂是澄清石灰水,装置④中带活塞的玻璃仪器名称是分液漏斗.
(1)上述反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)试用下图所列各装置设计一个实验,来验证上述反应所产生的各种产物.
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
g接c(或d),d(或c)接a,b接f.
(3)实验时可观察到装置①中A瓶中的溶液褪色,C瓶中的溶液不褪色.B瓶中的溶液的作用是除去SO2气体,避免对CO2的检验产生干扰;
(4)装置②中所加固体药品是无水硫酸铜,装置③中所加试剂是澄清石灰水,装置④中带活塞的玻璃仪器名称是分液漏斗.
6.某温度下,向4.0L恒容密闭容器中充入2.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
| 时间/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均反应速率为v(PCl3)=0.0064 mol/(L•s) | |
| B. | 若保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80% | |
| D. | 相同温度下,起始时向该容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆) |
10.下列关于平衡常数说法正确的是( )
| A. | 增大反应物的浓度,平衡常数K增大 | B. | 加大体系压强,平衡常数K增大 | ||
| C. | 加入负催化剂,平衡常数K减小 | D. | 升高温度,平衡常数K发生变化 |
20.氢气可通过下列反应制得:CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g)△H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是( )
| A. | 减小压强 | B. | 降低温度 | C. | 更换催化剂 | D. | 减小CO的浓度 |
7.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室用乙酸和异戊醇制备乙酸异戊酯的反应、装置示意图和有关数据如下:
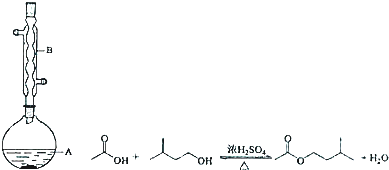
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2〜3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4,固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140〜143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是冷凝管或球形冷凝管,作用是冷凝回流,使反应物充分利用.
(2)碎瓷片的作用是防暴沸.
(3)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠等盐.
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(5)实验中加入少量无水MgS04的目的是干燥乙酸异戊酯.
(6)本实验的产率是d.
a.30% b.40% c.50% d.60%

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2〜3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水MgSO4,固体,静置片刻,过滤除去MgS04固体,进行蒸馏纯化,收集140〜143℃馏分,得乙酸异戊酯3.9g.
回答下列问题:
(1)装置B的名称是冷凝管或球形冷凝管,作用是冷凝回流,使反应物充分利用.
(2)碎瓷片的作用是防暴沸.
(3)在洗涤操作中,第一次水洗的主要目的是洗掉大部分硫酸和醋酸,第二次水洗的主要目的是洗掉碳酸氢钠等盐.
(4)在洗涤、分液操作中,应充分振荡,然后静置,待分层后d
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(5)实验中加入少量无水MgS04的目的是干燥乙酸异戊酯.
(6)本实验的产率是d.
a.30% b.40% c.50% d.60%
4.某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |