题目内容
14.某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$ Fe(OH)2+Ni(OH)2,下列说法中正确的是( )| A. | 充电时,阳极附近 pH 值减小 | |
| B. | 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O | |
| C. | 放电时,负极上发生反应的物质是Fe(OH)2 | |
| D. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
分析 放电时,Fe作负极、NiO2作正极,负极反应式为Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,电解质溶液为碱性溶液;充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应,据此分析解答.
解答 解:放电时,Fe作负极、NiO2作正极,负极反应式为Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,电解质溶液为碱性溶液;充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应,
A.充电时阳极反应式为Ni(OH)2+2 OH--2e-=NiO2+2H2O,OH-参加反应导致溶液碱性降低,溶液的pH减小,故A正确;
B.充电时阳极反应式为Ni(OH)2+2 OH--2e-=NiO2+2H2O,阴极反应式为 Fe(OH)2+2e-=Fe+2OH-,故B错误;
C.放电时发生反应的物质是Fe,故C错误;
D.放电时正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,碱性条件下溶液中不能大量存在氢离子,故D错误;
故选A.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应及充电电池中原电池和电解池关系是解本题关键,难点是电极反应式的书写.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
4.某化学小组想探究铁与浓硫酸能否反应产生气体,进行了如下实验:
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
【实验】甲同学在烧瓶中加入足量的铁丝与浓H2SO4溶液,开始无明显变化,对反应物加热,有气泡产生可收集到无色气体.
【查阅资料】①铁与浓硫酸在常温下会发生钝化,看不到明显现象,加热情况下会反应,产生有刺激性气味的二氧化硫气体;
②二氧化硫气体能使品红溶液褪色,能被氢氧化钠溶液吸收.
【提出假设】甲同学认为收集到的就是二氧化硫气体,乙同学认为还有氢气,你认为乙同学预测有氢气的理由是:随着反应的进行,浓硫酸会变稀,Fe会与稀硫酸反应产生氢气.
气体的组成可能有以下几种情况:
假设一:无色气体是SO2;
假设二:无色气体是H2;
假设三:无色气体是SO2 与H2 的混合气体.
【实验验证】请你设计实验验证上述假设三,完成下表中内容.小组同学在实验室找到可能在实验探究过程中能用到的试剂有:品红溶液、NaOH溶液、火柴、CuO粉末、无水硫酸铜,仪器任选.
| 实验方案与步骤 | 实验现象和结论 |
| 1.将少量气体通入盛有少量品红溶液的试管内; | 若品红溶液褪色,则无色气体中有SO2. |
| 2.将气体通过装有足量氢氧化钠溶液的洗气瓶后,用小试管收集气体,并在酒精灯上点燃 | 若收集到气体可以燃烧,则无色气体中有H2. 结合以上实验可知假设三成立. |
5.肼(H2N-NH2)是一种高能燃料,有关化学反应的为N2H4(g)+O2═N2(g)+2H2O(g)△H=-576KJ/mol,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,H-O为463则断裂1molN-H键所需的能量(kJ)是( )
| A. | 391 | B. | 194 | C. | 516 | D. | 658 |
9.下列图示实验正确的是( )
| A. |  除去粗盐溶液中不溶物 | B. |  碳酸氢钠受热分解 | ||
| C. |  制取少量Cl2 | D. |  稀硝酸与铜的反应制取并收集NO |
19.下列说法中有明显错误的是( )
| A. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| B. | 升高温度,一般可使活化分子的百分数增大,因而反应速率增大 | |
| C. | 对有气体参加的化学反应增大压强体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 | |
| D. | 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率 |
6.下列离子方程式正确的是( )
| A. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| C. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 钠投入到水中:Na+H2O═Na++OH-+H2↑ |
4.实验室制取少量N2常利用的反应是NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O,关于该反应的说法正确的是( )
| A. | NaNO2是氧化剂 | B. | NaNO2在反应中失电子 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
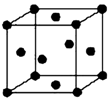 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.