题目内容
8.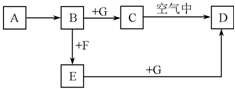 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.请回答问题.
(1)物质A的化学式是Fe.
(2)检验E溶液中的金属离子,常选用的试剂是2Fe2++Cl2=2Fe3++2Cl-(填化学式).
(3)溶液B与气体F反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-.
(4)物质C转化为物质D的反应中伴随的主要现象是白色沉淀迅速变成灰绿色,最终变成红褐色,化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(5)将SO2气体通入BaCl2溶液中无沉淀产生,再将此溶液一分为二,向其中一份中通入足量的氨气,有白色沉淀产生,该沉淀是BaSO3(填化学式).向另一份中滴加几滴E溶液也有白色沉淀产生,请用离子方程式表示该沉淀的产生过程SO32-+2Fe3++H2O=SO42-+2Fe2++2H+、SO42-+Ba2+═BaSO4↓.
分析 由转化关系可知A应为变价金属,应为Fe,F为有毒气体,应为Cl2,则B应为FeCl2,E为FeCl3,C为Fe(OH)2,D为Fe(OH)3,结合对应的物质以及题目要求可解答该题.
解答 解:由转化关系可知A应为变价金属,应为Fe,F为有毒气体,应为Cl2,则B应为FeCl2,E为FeCl3,C为Fe(OH)2,D为Fe(OH)3,
(1)由以上分析可知A为Fe,故答案为:Fe;
(2)检验Fe3+,可用KSCN,溶液呈红色,故答案为:KSCN;
(3)溶液B与气体F反应的离子方程式是2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)Fe(OH)2不稳定,易于空气中氧气发生反应生成Fe(OH)3,方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最终变成红褐色,
故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(5)将SO2气体通入BaCl2溶液中再通入足量的氨气,有BaSO3 白色沉淀产生,在SO2气体通入BaCl2溶液中再滴加几滴氯化铁溶液,铁离子氧化亚硫酸根离子,也有白色沉淀产生,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+2Fe2++2H+、SO42-+Ba2+═BaSO4↓,
故答案为:BaSO3;SO32-+2Fe3++H2O=SO42-+2Fe2++2H+、SO42-+Ba2+═BaSO4↓.
点评 本题考查无机物的推断,题目难度不大,注意根据反应的特点判断A为Fe为解答该题的关键,学习中注意相关元素化合物知识的积累.

练习册系列答案
相关题目
19.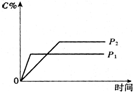 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
 温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )
温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g)?nC(g) 的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是( )| A. | P1>P2,n<3 | B. | P1<P2,n=3 | C. | P1<P2,n>3 | D. | P1>P2,n>3 |
16.下列物质的水溶液不具有漂白性的是( )
| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
17.硅及其化合物在材料领域中应用广泛.下列叙述中,不正确的是( )
| A. | 晶体硅是良好的半导体材料 | |
| B. | 光导纤维中成分和沙子中的主要成分相同 | |
| C. | 用通入澄清石灰水的方法可以区分出CO2和SO2气体 | |
| D. | SO2的漂白原理与木炭、过氧化钠及湿润氯气的漂白原理不同 |
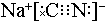 ,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.
,碳元素的化合价为+2;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2.若处理4×10-5mol•L-1的废水1000L,至少需要ClO2的质量为2.7g.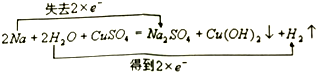 .
.