题目内容
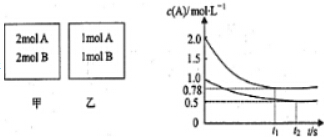
13.已知NO2和N2O4可以相互转化:2NO2(g)??N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图.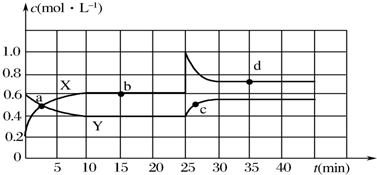
(1)图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是bd.下列不能说明该反应已达到平衡状态的是B.
A.容器内混合气体的压强不随时间变化而变化
B.容器内混合气体的密度不随时间变化而变化
C.容器内混合气体的颜色不随时间变化而变化
D.容器内混合气体的平均相对分子质量不随时间变化而变化
(2)①前10min内用NO2表示的化学反应速率v(NO2)=0.04mol•L-1•min-1.
②反应25min时,若只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是增大二氧化氮浓度(用文字表达),若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是BD.
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4.
分析 (1)根据反应方程式2NO2(g)?N2O4(g)可知,NO2的浓度变化是N2O4浓度变化量的2倍,据此结合图象中物质浓度的变化量判断;
物质的浓度不发生变化时表示化学反应处于平衡状态,根据图象判断处于平衡状态的点;容器内混合气体的体积不变,质量不变所以密度不变;
(2)①根据v=$\frac{△c}{△t}$计算v(NO2);
②由曲线看出25 min时,NO2的浓度突然增大;
根据压强对平衡的影响分析.
解答 解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
由图可知,10-25min及30min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,故b、d处于化学平衡状态,容器内混合气体的体积不变,质量不变所以密度不变,因此,密度不能判断平衡;
故答案为:X;bd;B;
(2)①X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线.由图可知,前10min内,NO2的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,所以υ(NO2)=$\frac{0.4mol/L}{10min}$=0.04mol•L-1•min-1,
故答案为:0.04;
②由曲线看出25 min时,NO2的浓度突然增大,可知改变的条件为增大NO2的浓度;
因在25 min时,增大了NO2的浓度,相当于增大了压强,平衡右移,d点时NO2的百分含量小于b时NO2百分含量,要使25 min时改变条件达到使NO2(g)的百分含量与d点相同的化学平衡状态,可加压,加入一定量的N2O4,也相当于加压,则BD符合;
故答案为:增大NO2的浓度;BD.
点评 本题考查改变外界条件对化学反应速率及化学平衡的影响、化学平衡图象、反应速率计算等,明确外界条件对化学反应速率影响原理及平衡移动影响原理是解本题关键,注意:只有反应前后改变的物理量不变时可逆反应才能达到平衡状态.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
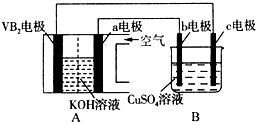
| A. | 根据图1可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. | 图2可能表示压强对可逆反应 A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图3可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 根据图4,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量Cu至pH在4左右 |
| A. | 煤 | B. | 氢气 | C. | 石油炼制品 | D. | 酒精 |
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
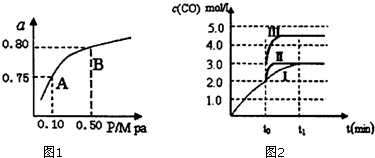
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;
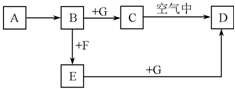 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.