题目内容
3.(1)写出符合以下离子方程式的化学方程式:Ba2++SO42-═BaSO4↓Na2SO4+BaCl2=BaSO4↓+2NaCl.(2)写出下列反应的离子方程式:铝与氢氧化钠溶液的反应:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)写出钠与硫酸铜溶液反应的化学方程式,并标出反应中电子转移的情况:
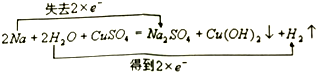 .
.
分析 (1)SO42-+Ba2+═BaSO4↓表示可溶性硫酸盐与可溶性钡盐反应生成硫酸钡沉淀和可溶性盐的一类反应;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(3)钠先与水反应生成氢氧化钠和氢气,然后氢氧化钠与硫酸铜溶液反应,据此写出总反应并标出电子转移的方向和数目.
解答 解:(1)可溶性硫酸盐与可溶性钡盐反应生成硫酸钡沉淀和可溶性盐的离子反应为:SO42-+Ba2+═BaSO4↓,如Na2SO4+BaCl2=BaSO4↓+2NaCl,
故答案为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
BaCl2+Na2SO4=BaSO4↓+2NaCl;
(2)铝与氢氧化钠溶液生成偏铝酸钠和氢气,该反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)钠先与水发生反应:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠再与硫酸铜溶液反应:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,总反应为:2Na+2H2O+CuSO4═Cu(OH)2↓+Na2SO4+H2↑,该反应中2个钠失去2个电子生成钠离子,水中2个氢离子得到2个电子生成氢气,用双线桥标出电子转移的方向和数目为: ,
,
故答案为: .
.
点评 本题考查了离子方程式、化学方程式的书写及氧化还原反应的分析,题目难度中等,明确离子方程式的书写原则为解答关键,注意掌握离子方程式表示的意义,能够用双线桥、单线桥分析氧化还原反应.

练习册系列答案
相关题目
13.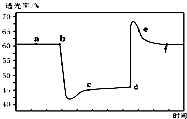 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
 已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )
已知反应:2NO2(g)+4CO(g)?N2(g)+4CO2(g)△H<0.将一定量的NO2与CO充入装有催化剂的注射器中后封口.右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法不正确的是( )| A. | b点的操作是快速压缩注射器 | |
| B. | c点与a点相比,c(NO2)、c(N2)都增大 | |
| C. | e点:υ(正)<υ(逆) | |
| D. | 若考虑体系温度变化,且没有能量损失,则平衡常数K(c)>K(f) |
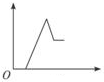
18.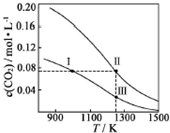 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1mol CO2和0.2mol CO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 化学平衡常数K:K(状态Ⅰ)<K(状态Ⅱ)<K(状态Ⅲ) | |
| B. | CO2的平衡转化率α:α(状态Ⅰ)<α(状态Ⅱ)=α(状态Ⅲ) | |
| C. | 体系中c(CO):c (CO,状态Ⅱ)<2c (CO,状态Ⅲ) | |
| D. | 逆反应速率v逆:v逆(状态Ⅰ)>v逆(状态Ⅲ) |
15.NA为阿伏加德罗常数,下列物质所含原子数最多的是( )
| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
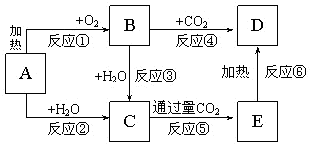 如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.
如图所示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色.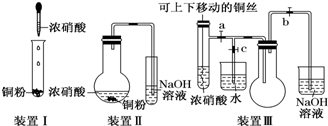
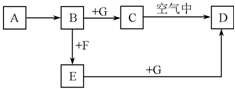 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.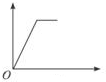
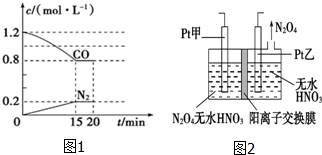 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: