题目内容
16.下列物质的水溶液不具有漂白性的是( )| A. | NH3 | B. | HClO | C. | SO2 | D. | Na2O2 |
分析 A、氨气溶于水生成一水合氨,不能用于杀菌、消毒、漂白;
B、次氯酸具有强氧化性,能用于杀菌、消毒、漂白;
C、二氧化硫具有漂白性,能使有色物质褪色;
D、过氧化钠具有强氧化性,具有漂白性.
解答 解:A、氨气本身没有漂白性,溶于水后与水反应生成一水合氨,是一元弱碱溶液显碱性,不具有漂白性,故A选;
B、次氯酸具有具有强氧化性,能使某些染料和有机色素褪色,具有漂白性,故B不选;
C、SO2可与有机色素发生化合反应而使有色物质褪色,表现了二氧化硫的漂白作用,故C不选;
D、Na2O2的水溶液可生成具有漂白性的H2O2,均具有强氧化性,能把有机色素氧化为无色物质,具有漂白性,故D不选;
故选A.
点评 本题考查物质的漂白性,掌握高中常见的具有漂白性的物质,并理解其漂白原理,如活性炭、过氧化钠、二氧化硫、次氯酸等,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如表:
请回答:
(1)不考虑其它组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol•Lˉ1否
(选填“是”或“否”);该混合溶液中离子浓度c(Aˉ)与c(Na+)的大小关系是C;
A.前者大 B.后者大 C.二者相等 D.无法判断
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)=c(A-)=c(OH-)=c(H+);
(3)丁组实验所得混合溶液中,写出下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简).c(Na+)-c(Aˉ)=10-5-10-9 mol•Lˉ1.
请回答:
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
(选填“是”或“否”);该混合溶液中离子浓度c(Aˉ)与c(Na+)的大小关系是C;
A.前者大 B.后者大 C.二者相等 D.无法判断
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)=c(A-)=c(OH-)=c(H+);
(3)丁组实验所得混合溶液中,写出下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简).c(Na+)-c(Aˉ)=10-5-10-9 mol•Lˉ1.
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1 molAl3+离子含有的核外电子数为3NA | |
| B. | 1.7gH2O2中含有的电子数为0.9NA | |
| C. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5NA个 | |
| D. | 标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
4.下列有关硅及其化合物的叙述中,正确的是( )
| A. | SiO2不溶于水,也不溶于酸和碱 | B. | SiO2是制造太阳能电池的常用材料 | ||
| C. | 硅是地壳中含量最多的非金属元素 | D. | 水玻璃可用作木材防火剂 |
1.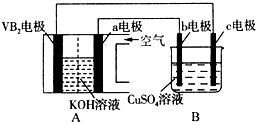 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | 外电路中电子由c电极流向VB2电极 | |
| D. | 若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.1 mol/L |
5.从人类生存的环境考虑,未来理想的燃料应是( )
| A. | 煤 | B. | 氢气 | C. | 石油炼制品 | D. | 酒精 |
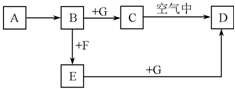 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.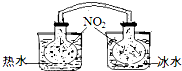 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深