题目内容
14.镁、铁、钨、钒的化合物在科学研究和工业生产中用途非常广泛.Mg2Ni是一种储氢合金,已知:Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
(1)写出Mg2Ni和MgH2 反应生成Mg和Mg2NiH4的热化学方程式:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol
(2)一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g),为模拟上述反应,在实验室中准确称取4.5×10-3mol碘、6.0×10-3mol金属钨放置于50.0mL密闭容器中,并加热使其反应.如图1是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.请回答下列问题:

①该反应是放热(填“放热”或“吸热”)反应.450℃该反应的化学平衡常数K=0.5;
?②反应从开始到t1(t1=3min)时间内的平均速率:v(I2)=1.0×10-2mol•L-1•min-1
③能够说明上述反应已经达到平衡状态的有bc
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物
质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
(3)烟气(主要含SO2、CO2)在较高温度经如图2所示方法脱除SO2,并制得H2SO4.
①在阴极放电的物质是O2.
②在阳极生成SO3的电极反应式是2SO42--4e-=2SO3↑+O2↑.
分析 (1)已知:①Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
根据盖斯定律,②-①×2可得:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s);
(2)①由图可知,升高温度,WI2的物质的量减少,说明化学平衡逆向移动,正反应为放热反应;
450℃平衡时,n(WI2)=1.5×10-3mol,则n(I2)=4.5×10-3mol-1.5×10-3mol=3×10-3mol,反应前后气体体积不变,用物质的量代替浓度代入K=$\frac{c(W{I}_{2})}{c({I}_{2})}$计算平衡常数;
②根据v=$\frac{△c}{△t}$计算v(I2);
③可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
解答 解:(1)已知:①Mg(s)+H2(g)=MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=-64.4kJ•mol-1
根据盖斯定律,②-①×2可得:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol,
故答案为:Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H=+84.6kJ/mol;
(2)①由图可知,升高温度,WI2的物质的量减少,说明化学平衡逆向移动,正反应为放热反应;
450℃平衡时,n(WI2)=1.5×10-3mol,则n(I2)=4.5×10-3mol-1.5×10-3mol=3×10-3mol,反应前后气体体积不变,用物质的量代替浓度计算平衡常数,则K=$\frac{c(W{I}_{2})}{c({I}_{2})}$=$\frac{1.5×1{0}^{-3}}{3×1{0}^{-3}}$=0.5,
故答案为:放热;0.5;
②△n(I2)=n(WI2)=1.5×10-3mol,则v(I2)=$\frac{\frac{1.5×1{0}^{-3}mol}{0.05L}}{3min}$=1.0×10-2mol•L-1•min-1,
故答案为:1.0×10-2mol•L-1•min-1;
③a.平衡时I2与WI2的浓度与碘的转化率有关,平衡时不一定相等,故a错误;
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明单质碘的生成速率与消耗速率相等,反应到达平衡,故b正确;
c.容器容积不变,随反应进行容器内混合气体总质量增大,容器内混合气体的密度增大,当混合气体密度不再改变时,反应到达平衡,故c正确;
d.反应前后气体物质的量不变,恒温恒容下容器内气体压强始终不变,故d错误,
故选:bc;
(3)阴极发生还原反应,阳极发生氧化反应,由示意图可知,阴极是氧气获得电子得到SO42-,阳极是熔融硫酸钾中硫酸根失去电子生成SO3、O2.
①氧气在阴极获得电子,故答案为:O2;
②阳极电极反应方程式为:2SO42--4e-=2SO3↑+O2↑,故答案为:2SO42--4e-=2SO3↑+O2↑.
点评 本题考查化学平衡有关计算、化学反应速率、化学平衡常数、化学平衡状态判断、热化学方程式书写、电解原理等,题目素材陌生,侧重于考查学生运用知识分析解决问题能力,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
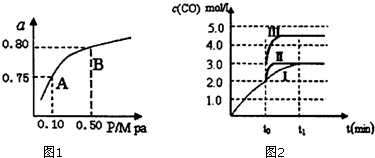
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”、“<”或“=”).据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1×K2(用K1、K2表示).
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积(快速)压缩至2L.
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O;
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3⑧浓H2SO4.
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |
| A. | NH4+、Cl-、NO3-、Na+ | B. | CO32-、NH4+、Cl-、Ca2+ | ||
| C. | 中性溶液中:Fe3+、Cl-、NO3-、Na+ | D. | Fe3+、Cl-、NO3-、Na+、SCN- |
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
下列选项正确的是( )
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
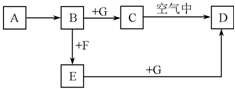 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.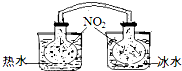 (1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深
(1)已知:2NO2 ?N2O4(g)△H<0.如图所示,放入热水中的NO2球产生的现象为红棕色变深 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: