题目内容
20.硫酸四氨合铜晶体([Cu(NH3)4]SO4•H2O)常用作杀虫剂、媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛.常温下该物质在空气中易与水和二氧化碳反应,生成铜的碱式盐,使晶体变成绿色的粉末.下面为硫酸四氨合铜晶体的制备以及NH3和SO42-质量百分数的测定实验.
步骤一:硫酸四铵合铜晶体的制备
发生反应为:CuSO4+4NH3•H2O═[Cu(NH3)4]SO4•H2O+3H2O.现取10g CuSO4•5H2O溶于14mL水中,加入20mL浓氨水,沿烧杯壁慢慢滴加95%的乙醇.静置析出晶体后,减压过滤,晶体用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在60℃左右小心烘干.
步骤二:NH3的质量百分数的测定(装置如图1所示)
称取0.250g 样品,放入250mL锥形瓶中,加80mL水溶解.在另一锥形瓶中,准确加入30mL 0.500mol•L-1 HCl标准溶液,放入冰水浴中.从漏斗中加入15mL 10% NaOH溶液,加热样品,保持微沸状态 1小时左右.蒸馏完毕后,取出插入HCl 溶液中的导管,用蒸馏水冲洗导管内外,洗涤液收集在氨吸收瓶中,从冰水浴中取出吸收瓶,加 2 滴酸碱指示剂,用0.500mol•L-1的NaOH标准溶液滴定,用去NaOH标准溶液22.00mL.
步骤三:SO42-质量百分数的测定
称取试样0.600g置于烧杯中,依次加入蒸馏水、稀盐酸、BaCl2溶液,水浴加热半小时.过滤,用稀硫酸洗涤.取下滤纸和沉淀置于已恒重的坩埚中在800-850℃灼烧至再次恒重,得到固体0.699g.
(1)步骤一加入95%乙醇的作用为降低硫酸四氨合铜晶体的溶解度,有利于晶体析出.此步骤进行两次洗涤操作,用乙醇与乙醚的混合液淋洗的目的为下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间.不采用蒸发浓缩、冷却结晶的方法制备硫酸四氨合铜晶体的原因为硫酸四氨合铜蒸发浓缩过程,受热分解可以生成NH3.
(2)步骤二装置中15mL 10% NaOH溶液加热样品,保持微沸状态 1小时左右的目的是将氨全部蒸出,从而得到准确的测量结果.通过此步骤测定NH3的质量百分数为27.2%.此实验
装置,如不使用空气冷凝管和冰水浴将使氨气的测定结果偏高(“偏高”、“不变”或“偏低”).
(3)步骤二中,根据酸碱中和滴定曲线分析,此实验中所加入的酸碱指示剂为B.
A.甲基橙 B.甲基红 C.酚酞
(4)步骤三中用稀硫酸洗涤的目的是BaSO4(s)?Ba2+(aq)+SO42-(aq),洗净杂质的同时,SO42-浓度升高使BaSO4的沉淀溶解平衡逆向移动,减少BaSO4的溶解(用必要的方程式和文字说明).该步骤中灼烧过程如果温度过高可生成一种有害气体和一种可溶于水的盐,写出该反应的化学方程式BaSO4+4C高$\frac{\underline{\;高温\;}}{\;}$4CO↑+BaS.
分析 (1)硫酸四铵合铜晶体的制备过程中,加入95%乙醇可以降低硫酸四氨合铜晶体的溶解度,有利于晶体析出,静置析出晶体后,减压过滤,晶体用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,由于下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间,然后将其在60℃左右小心烘干,以防止硫酸四氨合铜蒸发浓缩过程,受热分解生成NH3,据此答题;
(2)步骤二装置中15mL 10% NaOH溶液加热样品,保持微沸状态1小时左右,可以使溶液中的氨气充分挥发出来,根据滴定用去的氢氧化钠的物质的量可以计算出与氨反应的盐酸的物质的量,进而计算产生的氨气的物质的量,再计算出NH3的质量百分数;如不使用空气冷凝管和冰水浴将使氨气,盐酸会挥发,则消耗的氢氧化钠会偏少,据此分析;
(3)根据中和滴定的原理,指示剂的变色点 的pH值要与滴定终点的pH值接近,据此选择指示剂;
(4)用稀硫酸洗涤硫酸钡沉淀,可以减小硫酸钡的损失,滤纸和硫酸钡沉淀一起灼烧,滤纸碳化后可以硫酸钡发生氧化还原反应,生成一氧化碳和硫化钡,据此答题;
解答 解:(1)硫酸四铵合铜晶体的制备过程中,加入95%乙醇可以降低硫酸四氨合铜晶体的溶解度,有利于晶体析出,静置析出晶体后,减压过滤,晶体用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,由于下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间,然后将其在60℃左右小心烘干,以防止硫酸四氨合铜蒸发浓缩过程,受热分解生成NH3,
故答案为:降低硫酸四氨合铜晶体的溶解度,有利于晶体析出;下一步烘干温度较低,利用乙醇与乙醚易挥发的性质,得到较干燥的硫酸四氨合铜晶体,大量减少下一步烘干所用时间;硫酸四氨合铜蒸发浓缩过程,受热分解可以生成NH3;
(2)步骤二装置中15mL 10% NaOH溶液加热样品,保持微沸状态1小时左右,可以使溶液中的氨气充分挥发出来,与盐酸反应的氢氧化钠的物质的量为0.500mol•L-1×0.022L=0.011mol,所以与氨反应的盐酸的物质的量为0.030L×0.500mol•L-1-0.011mol=0.004mol,则产生的氨气的物质的量为0.004mol,所以NH3的质量百分数为$\frac{0.004×17}{0.250}$×100%=27.2%,如不使用空气冷凝管和冰水浴将使氨气,盐酸会挥发,则消耗的氢氧化钠会偏少,根据上面的计算过程可知,计算出的氨的质量分数会偏高,
故答案为:将氨全部蒸出,从而得到准确的测量结果;27.2%; 偏高;
(3)根据中和滴定的原理,指示剂的变色点 的pH值要与滴定终点的pH值接近,根据图中变色点的pH值可知,应选择甲基红,故选B;
(4)用稀硫酸洗涤硫酸钡沉淀,可以减小硫酸钡的损失,沉淀溶解平衡的方程式为BaSO4(s)?Ba2+(aq)+SO42-(aq),滤纸和硫酸钡沉淀一起灼烧,滤纸碳化后可以硫酸钡发生氧化还原反应,生成一氧化碳和硫化钡,反应方程式为BaSO4+4C 高$\frac{\underline{\;高温\;}}{\;}$4CO↑+BaS,
故答案为:BaSO4(s)?Ba2+(aq)+SO42-(aq),洗净杂质的同时,SO42-浓度升高使BaSO4的沉淀溶解平衡逆向移动,减少BaSO4的溶解;BaSO4+4C 高$\frac{\underline{\;高温\;}}{\;}$4CO↑+BaS.
点评 本题考查了物质的制备实验方案的设计、物质组成的测定,题目难度中等,试题综合性较强,知识点较全面,正确理解制备原理为解答关键,试题充分考查了学生的分析、理解能力、计算能力及化学实验能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 0.8molCO2 | B. | 标准状况下22.4LO2 | ||
| C. | 3.6g水 | D. | 含NA个NH3分子的氨气 |
| A. | 煤 | B. | 氢气 | C. | 石油炼制品 | D. | 酒精 |
| A. | 0.5mol•L-1的NaHSO3溶液与1.0mol•L-1的NaClO溶液等体积混合:HSO3-+ClO-═SO42-+Cl-+H+ | |
| B. | 向Ca(HCO3)2溶液中加入足量的澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液 ⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3⑧浓H2SO4.
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥⑦⑧ | D. | ⑤⑦⑧ |


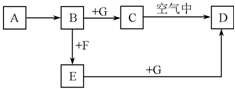 A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.
A~G是中学化学中常见的物质,在一定条件下它们之间的转化关系如图所示,其中A为金属,F是一种有毒的气体单质,G为NaOH溶液.