题目内容
10.有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:(1)A是H,B是O,C是Al,D是S,E是K(填写元素符号).
(2)B与D的氢化物中沸点较高的是H2O(填化学式),理由H2O分子之间形成氢键.
(3)元素B与D的电负性的大小关系是O>S,C与E的第一电离能的大小关系是Al>K(均填元素符号,填“>”、“<”或“=”).
(4)如何检验E元素焰色反应.
分析 A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×$\frac{1}{2}$=3,故C为Al.
解答 解:A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×$\frac{1}{2}$=3,故C为Al.
(1)由上述分析可知,A为H元素、B为O元素、C为Al、D为S元素、E为K元素,
故答案为:H;O;Al;S;K;
(2)B、D的氢化物分别为H2O、H2S,由于H2O分子之间形成氢键,而H2S不能,故H2O的沸点较高,
故答案为:H2O;H2O分子之间形成氢键;
(3)同主族自上而下电负性减小,故电负性O>S,金属性越强,第一电离能越小,故第一电离能:Al>K,
故答案为:O>S;Al>K;
(4)用焰色反应检验K元素,
故答案为:焰色反应.
点评 本题考查结构位置关系、元素周期表与元素周期律,元素的推断是解答的关键,注意同周期第一电离能异常情况.

练习册系列答案
相关题目
20.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铜片、石墨棒,乙醇 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、铂片,FeCl3溶液 |
5.有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是( )
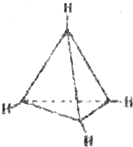

| A. | 该分子是极性分子 | B. | 每个碳原子均为sp2杂化 | ||
| C. | 分子中有极性键和非极性键 | D. | 分子中共有4个碳碳键 |
15.下列分子中,所有原子不可能处在同一平面上的是( )
| A. | CH4 | B. | CS2 | C. | H2O | D. | SO2 |
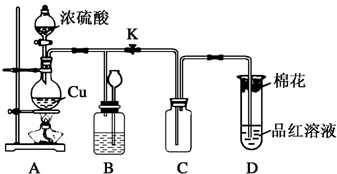
2.利用右图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
19.已烯雌酚是一种激素类药物,结构如下:

下列有关叙述中不正确的是( )

下列有关叙述中不正确的是( )
| A. | 可以用有机溶剂萃取 | |
| B. | 可与NaOH或NaHCO3溶液发生反应 | |
| C. | 1mol该有机物可以与5molBr2发生反应 | |
| D. | 该有机物分子中,可能有8个碳原子共平面 |
20.下列有关实验装置正确的是( )
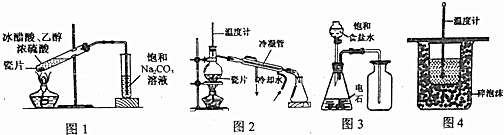

| A. | 用图1装置制取少量乙酸乙酯 | B. | 用图2装置分离苯和溴苯 | ||
| C. | 用图3装置制取并收集乙炔气体 | D. | 用图4装置测定中和热 |