题目内容
2.利用右图所示装置进行下列实验,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化锰与浓盐酸反应制备氯气,需要加热;
B.浓硫酸具有脱水性,蔗糖碳化后与浓硫酸反应生成二氧化硫、二氧化碳,二氧化硫具有漂白性;
C.盐酸与亚硫酸钠反应生成二氧化硫,二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀;
D.醋酸易挥发,醋酸与苯酚钠反应,干扰二氧化碳与苯酚钠的反应.
解答 解:A.二氧化锰与浓盐酸反应制备氯气,需要加热,而稀盐酸、二氧化锰不反应,盐酸易挥发,石蕊变红,故A错误;
B.浓硫酸具有脱水性,蔗糖碳化后与浓硫酸反应生成二氧化硫、二氧化碳,二氧化硫具有漂白性,则品红褪色,实验能得出相应实验结论,故B正确;
C.盐酸与亚硫酸钠反应生成二氧化硫,二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,结论不合理,故C错误;
D.醋酸易挥发,醋酸与苯酚钠反应,干扰二氧化碳与苯酚钠的反应,则该实验不能比较碳酸、苯酚的酸性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验、性质实验、实验装置的作用及实验结论等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
12.某有机物结构如图所示,下列说法错误的是( )
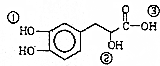

| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
13.常温下0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是( )
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键、氢键、共价键 | B. | 氢键、氢键、离子键 | ||
| C. | 氢键、共价键、分子间作用力 | D. | 分子间作用力、氢键、共价键 |
7.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下1LpH=11的氨水中含有阳离子总数为0.001NA | |
| B. | 4g${\;}_{1}^{2}$H2中所含的质子数为4NA | |
| C. | 1mol甲醇中含有C-H键的数目为4NA | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个氧原子 |
14.下列说法正确的是( )
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 蔗糖是还原性糖,能发生银镜反应 |
11.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如图1:
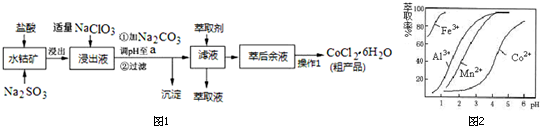
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)加入适量NaClO3作用是将Fe2+氧化为Fe3+;为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施加快搅拌速率;适当延长浸取时间;分数次浸取等(至少一条);若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出实验室常用来制备该气体的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)加入适量NaClO3作用是将Fe2+氧化为Fe3+;为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施加快搅拌速率;适当延长浸取时间;分数次浸取等(至少一条);若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出实验室常用来制备该气体的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
 ,
,