题目内容
18.某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.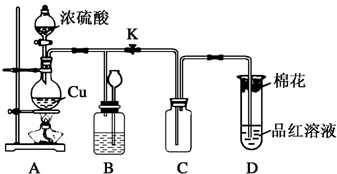
(1)装置A中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
(2)装置D中试管口放置的棉花应浸一种溶液,这种溶液是NaOH,其作用是吸收多余的SO2.
(3)装置B的作用是贮存多余的气体.当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是瓶中液面下降,漏斗液面上升,
(4)实验中,取一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,反应完毕时,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是随着反应进行浓H2SO4变为稀H2SO4,Cu不与稀H2SO4反应.
分析 (1)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(2)二氧化硫是污染性气体,不能排放到大气中,可以用氢氧化钠溶液吸收;
(3)装置B通过长颈漏斗中液面变化贮存二氧化硫;
(4)从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析.
解答 解:(1)浓硫酸具有强氧化性,在加热时可以氧化单质铜生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O;
(2)二氧化硫气体排放到大气中污染环境,所以装置D中试管口放置的棉花中应浸一种液体能与二氧化硫反应,可以浸氢氧化钠溶液或碳酸钠溶液等碱性溶液,作用是吸收多余的二氧化硫气体,防止污染空气,
故答案为:NaOH;吸收多余的SO2;
(3)可以通过B装置中长颈漏斗中液面上升来贮存二氧化硫;当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升,
故答案为:瓶中液面下降,漏斗液面上升;
(4)一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解,
故答案为:随着反应进行浓H2SO4变为稀H2SO4,Cu不与稀H2SO4反应.
点评 本题考查了浓硫酸的性质及其应用,题目难度中等,涉及浓硫酸的性质、反应产物的性质及验证等知识,熟练掌握浓硫酸的性质、二氧化硫的性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案| A. | 少量二氧化碳通入“水玻璃”中:C02+SiO32-+H20═C032-+H2SiO3↓ | |
| B. | 氨水滴入 AlCl3 溶液中:Al3++30H-═Al(0H)3↓ | |
| C. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | Al2O3溶于 NaOH 溶液中:Al2O3+2OH-+3H2O=2[Al(0H)4]- |
| A. | 原子半径:Br>Se>Cl | B. | 热稳定性:HF>HCl>H2S | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
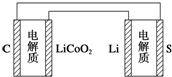 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
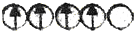 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )| A. | 能量最低原理 | B. | 洪特规则 | C. | 原子轨道能级图 | D. | 泡利不相容原理 |
| A. | 常温下1LpH=11的氨水中含有阳离子总数为0.001NA | |
| B. | 4g${\;}_{1}^{2}$H2中所含的质子数为4NA | |
| C. | 1mol甲醇中含有C-H键的数目为4NA | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个氧原子 |

| A. | a电极是该电池的正极 | B. | O2在b电极上发生氧化反应 | ||
| C. | 电解质溶液中OH-向正极移动 | D. | 该装置实现了化学能到电能的转化 |