题目内容
5.有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是( )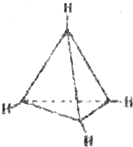
| A. | 该分子是极性分子 | B. | 每个碳原子均为sp2杂化 | ||
| C. | 分子中有极性键和非极性键 | D. | 分子中共有4个碳碳键 |
分析 A、分子中正负电荷中心不重合,分子为极性分子;分子中正负电荷的重心重合,则分子为非极性分子;
B、根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂质类型;
C、同种元素之间形成非极性共价键,不同元素之间形成极性共价键;
D、分子中含有6个碳碳键.
解答 解:A、 为正四面体,正负电荷中心重合,分子为非极性分子,故A错误;
为正四面体,正负电荷中心重合,分子为非极性分子,故A错误;
B、分子中C形成4个δ键,无孤电子对,为sp3杂化,故B正确;
C、分子中有C、H元素之间形成极性键,C-C元素之间形成非极性键,故C正确;
D、分子中含有6个碳碳键,故D错误;
故选C.
点评 本题主要考查了化学键与分子结构的关系,难度不大,注意非极性分子的结构对称,正负电荷中心重合来解答.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、C元素的名称氮、氟
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为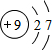 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
| A | C | |
| B |
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为
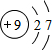 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
16.和NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
13.常温下0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是( )
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
20.现有部分短周期元素的性质或原子结构如下表:
(1)元素X在元素周期表中的位置为第二周期第ⅣA族,它的一种核素可测定文物年代,这种核素的符号是146C.
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
17.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键、氢键、共价键 | B. | 氢键、氢键、离子键 | ||
| C. | 氢键、共价键、分子间作用力 | D. | 分子间作用力、氢键、共价键 |
14.下列说法正确的是( )
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 蔗糖是还原性糖,能发生银镜反应 |
15.2016年4月22日世界地球日的主题为“珍惜地球资源,转变发展方式-提高资源利用效益”.下列说法不符合该主题的是( )
| A. | 利用农作物秸秆制取乙醇 | |
| B. | 回收地沟油,制备生物柴油 | |
| C. | 焚烧废旧塑料,防止白色污染 | |
| D. | 开发利用各种新能源,减少对化石燃料的依赖 |