题目内容
1.硫元素和人类的生存与发展联系密切,在战国时期,我国的炼丹家们就开始了对硫单质及含硫化合物的研究应用.Ⅰ.已知可溶性硫化物在溶液中能与硫单质反应,生成可溶性的多硫化物(如Na2Sn).请回答下列问题:
(1)在浓Na2S溶液中滴入少量氯水,经振荡,未发现沉淀物生成,其原因是(用离子子方程式表示,下同)S2-+Cl2=2Cl-+S↓,(n-1)S+S2-=Sn2-.
(2)在足量氯水中,滴入少量Na2S溶液,经振荡,也未发现沉淀物生成,若再加入盐酸酸化的BaCl2溶液,即可产生白色沉淀,其原因是S2-+4Cl2+4H2O=8Cl-+SO42-+8H+.
Ⅱ.无机或有机含氧酸分子去掉一个或多个羟基后成为酰基,如-SO2-称为硫酰(基),SO2Cl、SO2Cl2分别被称为亚硫酰氯、硫酰氯,它们都有很多相似的性质,如都能发生水解反应生成对应的酸,都可以做氯化试剂等.请回答下列问题:
(1)已知:SO2(g)+PCl5(s)?SOCl2(I)+POCl3(I)△H1=akJ/mol
PCl5(s)+H2O(I)?POCl3(I)+2HCl(g)△H2=bkJ/mol
写出SOCl2与H2O反应的热化学方程式SOCl2(I)+H2O(I)?SO2(g)+2HCl(g)△H=(b-a)KJ/mol.
(2)实验室将CaSO3和PCl5按物质的量之比1:2混合,微热,两者正好完全反应制得SOCl2,该反应的化学方程式为CaSO3+2PCl5=SOCl2+CaCl2+2POCl3.生成的SOCl2和AlCl3•6H2O混合共热制取无水AlCl3,其原因是SOCl2与结晶水反应生成SO2与HCl,HCl抑制Al3+水解.
(3)在一定条件下存在反应:SO2(g)+Cl2(g)?SO2Cl2(I)△H<0,现有3个体积均为10L的密闭容器Ⅰ、Ⅱ、Ⅲ,按如图投料,并在150℃初始条件下反应达平衡.

①容器Ⅰ和容器Ⅲ达到平衡所需时间tⅠ<tⅢ(填“>”、“<”或“=”)
②容器Ⅰ中SO2的转化率与容器Ⅱ中SO2Cl2的转化率之和<1(填“>”、“<”或“=”)
③容器Ⅲ中反应前总压为1atm,反应后的总压为0.75atm,则150℃该反应的平衡常数Kp=4atm-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
分析 Ⅰ.(1)Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子;
(2)在足量氯水中,氯气与硫离子反应生成硫酸根离子,加盐酸酸化的BaCl2溶液生成硫酸钡沉淀;
Ⅱ.(1)①SO2(g)+PCl5(s)?SOCl2(I)+POCl3(I)△H1=akJ/mol
②PCl5(s)+H2O(I)?POCl3(I)+2HCl(g)△H2=bkJ/mol
依据盖斯定律计算②-①得到;
(2)实验室将CaSO3和PCl5按物质的量之比1:2混合,微热,两者正好完全反应制得SOCl2,同时生成氯化钙和POCl3,结合原子守恒配平书写化学方程式,生成的SOCl2和AlCl3•6H2O混合共热制取无水AlCl3,是利用SOCl2与结晶水反应生成SO2与HCl抑制铝离子的水解;
(3)容器Ⅰ是绝热容器,反应过程中温度升高,平衡逆向进行,容器Ⅱ、Ⅲ是恒温恒容,反应从正逆反应分析进行达到相同的平衡状态,
①绝热容器中,随反应进行温度升高,反应速率增大,达到平衡所需时间短;
②若容器Ⅱ恒温恒容,容器Ⅰ是恒温恒容时,达到相同平衡状态,二氧化硫转化率和SO2Cl2的转化率之和为1,实际容器Ⅰ是绝热恒容,随着反应的进行,温度升高,平衡逆向进行,二氧化硫转化率减小;
③用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结合三行计算得到.
解答 解:Ⅰ.(1)在浓Na2S溶液中滴入少量氯水,Na2S与氯气反应生成S沉淀,S与S2-结合生成多硫离子,所以没有沉淀生成,其溶液中发生的反应为:S2-+Cl2=2Cl-+S↓,(n-1)S+S2-=Sn2-;
故答案为:S2-+Cl2=2Cl-+S↓;(n-1)S+S2-=Sn2-;
(2)在足量氯水中,滴入少量Na2S溶液,氯气与硫离子反应生成硫酸根离子,即S2-+4Cl2+4H2O=8Cl-+SO42-+8H+,所以没有沉淀生成,再加盐酸酸化的BaCl2溶液生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓;
故答案为:S2-+4Cl2+4H2O=8Cl-+SO42-+8H+;Ba2++SO42-=BaSO4↓;
Ⅱ.(1)①SO2(g)+PCl5(s)?SOCl2(I)+POCl3(I)△H1=akJ/mol
②PCl5(s)+H2O(I)?POCl3(I)+2HCl(g)△H2=bkJ/mol
依据盖斯定律计算②-①得到SOCl2与H2O反应的热化学方程式:SOCl2(I)+H2O(I)?SO2(g)+2HCl(g)△H=(b-a)KJ/mol,
故答案为:SOCl2(I)+H2O(I)?SO2(g)+2HCl(g)△H=(b-a)KJ/mol;
(2)实验室将CaSO3和PCl5按物质的量之比1:2混合,微热,两者正好完全反应制得SOCl2,同时生成氯化钙和POCl3,结合原子守恒配平书写化学方程式CaSO3+2PCl5=SOCl2+CaCl2+2POCl3,生成的SOCl2和AlCl3•6H2O混合共热制取无水AlCl3,是利用SOCl2与结晶水反应生成SO2与HCl抑制铝离子的水解;
故答案为:CaSO3+2PCl5=SOCl2+CaCl2+2POCl3,SOCl2与结晶水反应生成SO2与HCl,HCl抑制Al3+水解;
(3)①绝热容器中,随反应进行温度升高,反应速率增大,达到平衡所需时间短,容器Ⅰ和容器Ⅲ达到平衡所需时间tⅠ<t2,
故答案为:<;
②若容器Ⅱ恒温恒容,容器Ⅰ也是恒温恒容时,达到相同平衡状态,二氧化硫转化率和SO2Cl2的转化率之和为1,但实际容器Ⅰ是绝热恒容,随反应进行温度升高,平衡逆向进行,二氧化硫转化率减小,因此容器Ⅰ中SO2的转化率与容器Ⅱ中SO2Cl2的转化率之和小于1,故答案为:<;
③用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结合三行计算得到,设反应二氧化硫物质的量为x
SO2(g)+Cl2(g)?SO2Cl2(g)△H<0
起始量(mol) 1 1 0
变化量(mol) x x x
平衡量(mol) 1-x 1-x x
压强之比等于物质的量之比:$\frac{2}{2-x}$=$\frac{1}{0.75}$
x=0.5mol,
平衡常数K=$\frac{0.75×\frac{0.5}{2-0.5}}{0.75×\frac{1-0.5}{2-0.5}×0.75×\frac{1-0.5}{2-0.5}}$=4atm-1,
故答案为:4atm-1.
点评 本题考查了热化学方程式书写、氧化还原反应分析、盐类水解原理、影响化学平衡的因素、平衡常数计算等知识点,掌握基础是解题关键,题目难度中等.

 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
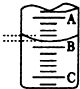
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.
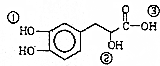
| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
| A. | 原子半径:Br>Se>Cl | B. | 热稳定性:HF>HCl>H2S | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
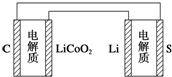 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
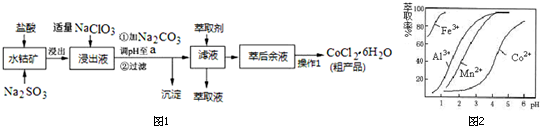
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)加入适量NaClO3作用是将Fe2+氧化为Fe3+;为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施加快搅拌速率;适当延长浸取时间;分数次浸取等(至少一条);若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出实验室常用来制备该气体的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)