题目内容
20.下列各组的电极材料和电解液,不能组成原电池的是( )| A. | 铜片、石墨棒,乙醇 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、铂片,FeCl3溶液 |
分析 根据原电池的构成条件判断是否能构成原电池,原电池的构成条件是:1、有两种活泼性不同的金属(或其中一种为非金属导体)作电极;2、电极均插入电解质溶液中;3、两极相互连接(或接触);4、能自发的发生氧化还原反应.
解答 解:A.乙醇为非电解质,溶液不导电,不能形成原电池,故A选;
B.两电极的活泼性不同,且铜片与硝酸银溶液能自发的发生氧化还原反应,所以能构成原电池,故B不选;
C.两金属的活泼性不同,且锌片与稀盐酸能自发的发生氧化还原反应,所以能构成原电池,故C不选;
D.两金属的活泼性不同,且铜片与氯化铁溶液能自发的发生氧化还原反应,所以能构成原电池,故D不选.
故选A.
点评 本题考查了原电池的设计,为高频考点,侧重于学生的分析能力以及双基的考查,难度不大,根据原电池的构成条件分析判断即可.

练习册系列答案
相关题目
20.具有顺反异构体的物质是( )
| A. |  | B. |  | ||
| C. |  | D. | H2C═CH2 |
11. 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
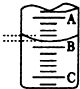
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显少于后两次,其原因可能是AE
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.
 草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
草酸(H2C2O4)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5,具有还原性,溶于水,溶液有酸性,为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.滴定原理为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O(1)滴定管在使用之前,必须进行的操作是检查是否漏水,滴定时,KMnO4溶液应装在酸式滴定管(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点时的现象为滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,C处的刻度为20,滴定管中液面读数应为19.40mL,此时滴定管中液体的体积大于30.60mL.(填大于、小于或等于)
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 22.32 | 24.39 | 24.41 |
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过后,未用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗,
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出H2C2O4的物质的量浓度的表达式(必须化简):C=$\frac{61c}{V}$mol/L.
(5)请你一个设计简单实验证明草酸的酸性强于碳酸,实验操作及现象是取少量的NaHCO3于试管中,加入草酸溶液,有气泡产生.
8.下列离子反应方程式不正确的是( )
| A. | 少量二氧化碳通入“水玻璃”中:C02+SiO32-+H20═C032-+H2SiO3↓ | |
| B. | 氨水滴入 AlCl3 溶液中:Al3++30H-═Al(0H)3↓ | |
| C. | 铝溶解在NaOH溶液中:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ | |
| D. | Al2O3溶于 NaOH 溶液中:Al2O3+2OH-+3H2O=2[Al(0H)4]- |
15.A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
(1)写出A、C元素的名称氮、氟
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
| A | C | |
| B |
(2)B元素最高价氧化物对应水化物的化学式为H2SO4,该化合物为共价(填“共价”或“离子”)化合物.
(3)C的原子结构示意图为
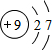 ,C的单质与H2反应的化学方程式为:H2+F2=2HF
,C的单质与H2反应的化学方程式为:H2+F2=2HF(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有离子键、共价键.
5.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
12.某有机物结构如图所示,下列说法错误的是( )
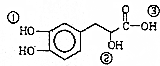

| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
9.已知16S和34Se位于同一主族,下列关系正确的是( )
| A. | 原子半径:Br>Se>Cl | B. | 热稳定性:HF>HCl>H2S | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |